题目内容
13.用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )| A. | NH4+为正四面体形 | B. | CS2为直线形 | ||
| C. | ClO3-的空间构型为平面三角形 | D. | PCl3为三角锥形 |
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,据此判断杂质类型以及立体结构.
解答 解:A.NH4+中N原子的价层电子对个数=4+$\frac{1}{2}$×(5-1-4×1)=4且不含有孤电子对,所以其空间构型为四面体结构,故A正确;
B.CS2分子中价层电子对个数=2+$\frac{1}{2}$×(4-2×2)=2且不含有孤电子对,所以为直线形结构,故B正确;
C.ClO3-中Cl的价层电子对数=3+$\frac{1}{2}$(7+1-2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故C错误;
D.PCl3分子中B原子的价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含一个有孤电子对,所以其空间构型为三角锥形,故D正确;
故选C.
点评 本题考查了微粒空间构型的判断,利用价层电子对互斥理论分析解答即可,难点是孤电子对的计算方法,题目难度不大.

练习册系列答案
相关题目
16.已知2L 0.5mol/L H2SO4溶液与足量稀NaOH溶液反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式正确的是( )
| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| C. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=+57.3 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
17.柠檬烯是一种食用香料,其结构简式为: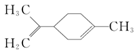 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它在核磁共振氢谱中有6个峰 | B. | 它能发生取代、加成和氧化反应 | ||
| C. | 它与丁基苯互为同分异构体 | D. | 它属于芳香族化合物 |
1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )


| A. | 升高温度,可能引起由c向b的变化 | |
| B. | 该温度下,水的离子积常数为1.0×10-13 | |
| C. | 该温度下,加入HCl溶液可能引起由b向a的变化 | |
| D. | 该温度下,稀释溶液可能引起由c向d的变化 |
18.据北京市园林局的不完全统计,城八区范围内共有11000余株行道树、149万余株绿篱、色块等灌木、近20万平方米草坪遭受严重盐害或死亡,直接影响了2008年“绿色奥运”开展.我国今年遭遇了特大雪灾,我国科学家用氯化钙、尿素、葡萄糖酸钠等为原料成功研制出一种新型复合融雪剂.下列说法正确的是( )
| A. | 葡萄糖酸钠是非电解质 | |
| B. | 传统的氯化钠融雪剂由于价格偏高而减少使用 | |
| C. | 大量使用传统的氯化钠融雪剂会造成植物枯死 | |
| D. | 传统的氯化钠融雪剂通过升高水的凝固点实现雪融化 |
5.下列各组可用同种方法除去杂质(括号内物质)的是( )
| A. | 植物油(水)与乙醇(水) | B. | 蛋白质溶液(NaCl)与淀粉溶液(KI) | ||
| C. | 泥水(淀粉溶液)与Fe(OH)3胶体(FeCl3) | D. | 氧化钙(碳酸钙)与NaHCO3 (Na2CO3) |
2.下列实验操作或说法正确的是( )
| A. | 取4g NaOH加入100mL水中配制浓度为1.0mol/L的NaOH溶液 | |
| B. | 配制一定浓度的溶液时,用蒸馏水润洗容量瓶会使所配制出的溶液浓度偏低 | |
| C. | 除去Fe(OH)3胶体中混有的Cl-离子,可用过滤的方法 | |
| D. | 向盛有铜片的试管中加入浓硫酸,加热证明浓硫酸具有强氧化性 |
3.a g H2SO4中含有b个氢原子,则阿伏加德罗常数为( )
| A. | $\frac{49a}{b}$ mol-1 | B. | $\frac{49b}{a}$ mol-1 | C. | $\frac{98a}{b}$ mol-1 | D. | $\frac{98b}{a}$ mol-1 |