题目内容
15.短周期主族元素X、Y、Z、U、W原子序数依次增大,X位于 IA族,Y原子最外层电子数是其内层电子数的2倍,Z的简单气态氢化物的稳定性最强,U是地壳中含量最多的金属元素,W与Z属于同一主族,下列叙述正确的是( )| A. | 由X与W形成的化合物是离子化合物 | |
| B. | Z元素的最低化合价为-1,最高化合价为+7 | |
| C. | Y的最高价氧化物对应水化物的酸性比U的强 | |
| D. | Z的简单离子半径小于U的简单阳离子半径 |
分析 短周期主族元素X、Y、Z、U、W原子序数依次增大,Y原子最外层电子数是其内层电子数的2倍,Y为C元素;Z的简单气态氢化物的稳定性最强,Z为F元素;U是地壳中含量最多的金属元素,U为Al元素;W与Z属于同一主族,W为Cl元素,X位于IA族,且原子序数小于6,可知X为H或Li,以此来解答.
解答 解:由上述分析可知,X为H或Li,Y为C,Z为F,U为Al,W为Cl,
A.X与W形成的化合物可能为HCl,含共价键,为共价化合物,故A错误;
B.Z为F,不存在正价,故B错误;
C.非金属性C>Al,则Y的最高价氧化物对应水化物的酸性比U的强,故C正确;
D.具有相同电子排布的离子中,原子序数大的离子半径小,则Z的简单离子半径大于U的简单阳离子半径,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
5.下列有关说法正确的是( )
| A. | 室温时,0.1 mol•L-1某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 | |
| B. | 反应CO(g)+3H2(g)=CH4(g)+H2O(g)一定条件下可自发进行,则该反应的△H>0 | |
| C. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 | |
| D. | 为减小中和滴定误差,锥形瓶和滴定管必须洗净并润洗后才能使用 |
6.下列指定反应的离子方程式正确的是( )
| A. | 向MgCl2溶液中滴加过量氨水:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu═2Fe+3Cu2+ | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
3.下列有关物质的性质与用途具有对应关系的是( )
| A. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| B. | Al具有良好的延展性和抗腐蚀性,常用铝箔包装物品 | |
| C. | 浓H2SO4溶液能使蛋白质发生盐析,可用于杀菌消毒 | |
| D. | 铜的金属活动性比铁的弱,可在海外轮外壳上装若干铜块以减缓其腐蚀 |
10. 某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
 某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )
某温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下,能够大量共存的一组离子是( )| A. | a点对应的溶液:Na+、K+、SO42-、Cl- | |
| B. | b点对应的溶液:I-、Mg2+、K+、ClO- | |
| C. | c点对应的溶液:Na+、S2-、F-、NH4+ | |
| D. | a点对应的溶液:CO32-、Cl-、Al3+、SO42- |
20.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol/L NaHSO4溶液中:K+、AlO2-、Cl-、CH3COO- | |
| B. | 0.1mol/L NaHCO3溶液中:Al3+、Ca2+、SO42-、NO3- | |
| C. | 0.1mol/L FeCl3溶液中:NH4+、NO3-、Na+、SO42 | |
| D. | 0.1mol/L H2O2溶液中:Na+、K+、SO42-、I- |
7.尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如图转化:
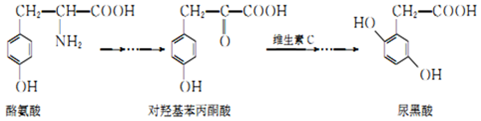
下列说法错误的是( )

下列说法错误的是( )
| A. | 酪氨酸既能与盐酸反应,又能与NaOH溶液反应 | |
| B. | 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子 |
4.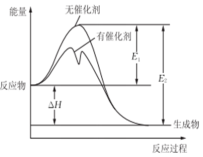 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | E1-E2=△H | |
| C. | 升高温度,不会提高活化分子的百分数 | |
| D. | 使用催化剂使该反应的化学平衡常数发生改变 |
16.已知2L 0.5mol/L H2SO4溶液与足量稀NaOH溶液反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式正确的是( )
| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| C. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=+57.3 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |