题目内容
7.科技工作者制造出厚度只有l微米的超薄太阳能电池.硅太阳能电池工作原理如图所示:
下列有关判断错误的是( )
| A. | 硅原子最外层有4个电子 | |
| B. | 太阳能电池是一种化学电源 | |
| C. | 太阳能电池实现了光能向电能的转化 | |
| D. | B电极为电源正极 |
分析 太阳能电池将光能转化为电能,由电流方向可知B为正极,A为负极,以此解答该题.
解答 解:A.硅的原子序数为14,最外层电子数为4,故A正确;
B.光能转化为电能,不是化学电源,故B错误;
C.太阳能电池将光能转化为电能,故C正确;
D.由电流方向可知B电极为电源正极,故D正确.
故选B.
点评 本题考查原电池知识,为高频考点,侧重于原电池的工作原理的考查,注意把握电极反应的判断,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
6.下列指定反应的离子方程式正确的是( )
| A. | 向MgCl2溶液中滴加过量氨水:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | 将Cu粉加入到Fe2(SO4)3溶液中:2Fe3++3Cu═2Fe+3Cu2+ | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
7.尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如图转化:
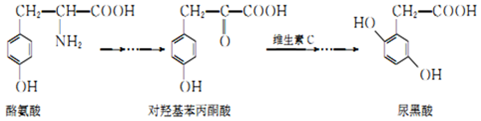
下列说法错误的是( )

下列说法错误的是( )
| A. | 酪氨酸既能与盐酸反应,又能与NaOH溶液反应 | |
| B. | 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| D. | 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子 |
4.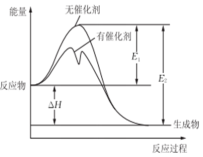 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
 2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )
2SO2(g)+O2(g)?2SO3(g)反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能.下列有关叙述正确的是( )| A. | 该反应为吸热反应 | |
| B. | E1-E2=△H | |
| C. | 升高温度,不会提高活化分子的百分数 | |
| D. | 使用催化剂使该反应的化学平衡常数发生改变 |
2. 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
请回答:
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
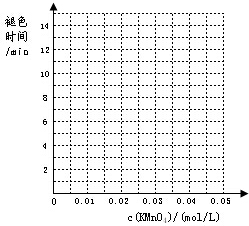
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
 草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:
草酸(H2C2O4)是一种二元弱酸,部分性质如下:能溶于水,易溶于乙醇;大约在175℃升华(175℃以上分解生成H2O、CO2和CO);H2C2O4+Ca(OH)2=CaC2O4↓+2H2O.现用H2C2O4进行如下实验:(一) 探究草酸的不稳定性
通过如图实验装置验证草酸受热分解产物中的CO2和CO,A、B、C中所加入的试剂分别是:

A、乙醇 B、Ca(OH)2或Ba(OH)2C、NaOH溶液.
(1)B中盛装的试剂Ca(OH)2或Ba(OH)2(填化学式)
(2)A中加入乙醇的目的是除去H2C2O4,避免对CO2的检验造成干扰.
(二) 探究草酸的酸性
将0.01mol草酸晶体(H2C2O4•2H2O)加入到100ml 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈碱性,其原因是C2O42-+H2O?HC2O4-+OH-(用离子方程式表示).
(三) 用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素
I、实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□MnO4-+□H2C2O4+□6H+=□Mn2++□CO2↑+□H2O
(1)配平上述离子方程式.
(2)滴定时KMnO4溶液应盛装于酸式(填“酸式”或“碱式”)滴定管中.
Ⅱ、探究影响化学反应速率的因素
如表列出了在“探究影响化学反应速率的因素”实验中得出的部分实验数据:
| 实验组别 | c(H2C2O4) /(mol/L) | V(H2C2O4) /ml | c(KMnO4) /(mol/L) | V(KMnO4) /ml | c(H2SO4) /(mol/L) | 褪色所需时间 | 实验 目的 |
| 1 | 0.2 | 2 | 0.0025 | 4 | 0.12 | 6′55″ | (a)探究KMnO4溶液浓度对化学反应速率的影响 |
| 0.2 | 2 | 0.005 | 4 | 0.12 | 5′17″ | ||
| 0.2 | 2 | 0.01 | 4 | 0.12 | 3′20″ | ||
| 0.2 | 2 | 0.02 | 4 | 0.12 | 9′05″ | ||
| 0.2 | 2 | 0.03 | 4 | 0.12 | 11′33″ | ||
| 0.2 | 2 | 0.04 | 4 | 0.12 | 14′20″ |
(1)实验目的(a)是探究KMnO4溶液浓度对化学反应速率的影响;
(2)根据表中数据在右边坐标中画出反应褪色所需时间随KMnO4溶液浓度的变化关系图象;
(3)若要探究催化剂对该反应速率的影响应选择MnSO4而不选MnCl2作为催化剂,其原因是氯离子可与酸性高锰酸钾发生氧化还原反应.
19.在KNO3、MgSO4、K2SO4组成的混合溶液中Mg2+0.5mol、NO3-0.2mol、SO42-0.6mol,则溶液中K+的物质的量为( )
| A. | 0.4mol | B. | 0.3mol | C. | 0.2mol | D. | 0.1mol |
16.已知2L 0.5mol/L H2SO4溶液与足量稀NaOH溶液反应,放出114.6kJ的热量,表示该反应中和热的热化学方程式正确的是( )
| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=+114.6 kJ•mol-1 | |
| C. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=+57.3 kJ•mol-1 | |
| D. | $\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ•mol-1 |
17.柠檬烯是一种食用香料,其结构简式为: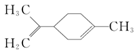 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它在核磁共振氢谱中有6个峰 | B. | 它能发生取代、加成和氧化反应 | ||
| C. | 它与丁基苯互为同分异构体 | D. | 它属于芳香族化合物 |
 ;若反应中生成0.2mol HNO3,转移的电子数目为0.4NA个.
;若反应中生成0.2mol HNO3,转移的电子数目为0.4NA个.