题目内容
12.表是0.1mol/L的部分阳离子常温下以氢氧化物形式沉淀时溶液的pH:| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |
分析 A.由表格数据可知,Fe3+开始沉淀的pH最小;
B.先加入稀硝酸,将亚铁离子氧化为铁离子,结合铁离子的沉淀pH利用CuO促进铁离子水解转化为沉淀;
C.阳离子浓度相同时,OH-浓度越大,Ksp越大;
D.Fe均与Cu2+、Fe3+反应.
解答 解:A.由表格数据可知,Fe3+开始沉淀的pH最小,则在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe3+先产生沉淀,故A错误;
B.先加入稀硝酸,将亚铁离子氧化为铁离子,再加入氧化铜调节溶液的pH的范围为3.2-4.7,可除去混合溶液中的Fe2+、Fe3+,故B正确;
C.阳离子浓度相同时,OH-浓度越大,Ksp越大,由表格中的数据可知,相同温度下,Ksp[(Cu(OH)2)<Ksp[(Fe(OH)2),故C错误;
D.Fe均与Cu2+、Fe3+反应,不能除杂,可先加入稀硝酸,再加入氧化铜除杂,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的比较、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、水解原理的应用,题目难度不大.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
5.下列离子方程式书写正确的是( )
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| B. | 硫酸与氢氧化镁溶液:H++OH-═H2O | |
| C. | 碳酸钙与稀硝酸:CO32-+2H+═CO2↑+H2O | |
| D. | 铁与稀硫酸反应:Fe+2H+═Fe2++H2↑ |
6.用NA表示阿伏伽德罗常数,下列说法正确的有( )
| A. | 1molNa2O2晶体中共含有4NA个离子 | |
| B. | 0.1mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| C. | 常温常压下16gO2和O3混合气体含有NA个氧原子 | |
| D. | 1mol/LNa2CO3溶液中含有NA个CO32- |
3.有人常用废旧报纸包装食品,这是极不卫生的.原因是报纸上除含有多种病菌外,还会含有易使人中毒的多氯联苯和( )
| A. | 铅 | B. | 机油 | C. | 三氯化锑 | D. | 硫 |
4.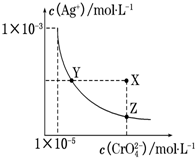 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
 在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示. 又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点 | |
| C. | t℃时,Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | t℃时,将0.01 mol•L-1 AgNO3溶液滴入20 mL 0.01 mol•L-1 KCl和0.01 mol•L-1 K2CrO4的混合溶液中,CrO42-先沉淀 |
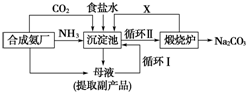
2.以下是在实验室模拟“侯氏制碱法”生产流程的示意图,有关叙述错误的是( )


| A. | A气体是NH3 | |
| B. | 悬浊液的离子主要有Na+、NH4+、Cl-、HCO3- | |
| C. | 第Ⅲ步操为过滤 | |
| D. | 第Ⅳ步操作所使用的仪器主要有铁架台、酒精灯、蒸发皿、玻璃棒 |