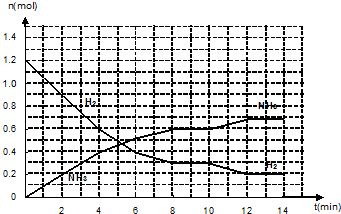
题目内容
17.我国化学家侯德榜改革国外的纯碱生产工艺,探索出了一种生产纯碱的方法,其生产流程可简要表示如下: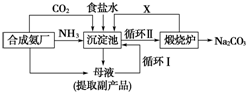
(1)上述生产纯碱的方法称侯德榜制碱法(或联合制碱法),副产品的一种用途为用做农作物的化肥.
(2)沉淀池中发生反应的化学方程式是NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
(3)写出上述流程中X物质的分子式为CO2.
(4)从沉淀池中取出沉淀的操作叫过滤.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加硝酸酸化的硝酸银溶液.
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有ac.
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出NH4Cl的纯度.
分析 (1)将二氧化碳和氨气、食盐水加入沉淀池中,发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,得到的沉淀在煅烧炉中发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,从而得到Na2CO3,副产品是氯化铵,此法为侯氏制碱法;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体;
(3)煅烧炉中碳酸氢钠分解生成碳酸钠、二氧化碳和水,二氧化碳可以循环使用;
(4)分离固体和溶液采用过滤方法;
(5)氯离子与银离子反应生成不溶于硝酸的氯化银沉淀,据此检验氯离子存在;
(6)向母液中通氨气,溶液中的铵根离子浓度增大有利于氯化铵晶体析出,可以是碳酸氢钠转化为溶解度更大的碳酸钠,提高氯化铵的纯度.
解答 解:将二氧化碳和氨气、食盐水加入沉淀池中,发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,得到的沉淀在煅烧炉中发生反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2,从而得到Na2CO3,副产品是氯化铵,此法为侯氏制碱法.
(1)该法为侯德榜制碱法(或联合制碱法);副产品氯化铵可以用作氮肥,
故答案为:侯德榜制碱法(或联合制碱法); 用做农作物的化肥;
(2)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;过滤;
(3)煅烧炉中碳酸氢钠分解生成碳酸钠、二氧化碳和水,二氧化碳可以循环使用,所以X为二氧化碳,分子式为CO2;
故答案为:CO2;
(4)分离固体和溶液采用过滤方法,所以从沉淀池中取出沉淀的操作是过滤;
故答案为:过滤;
(5)氯离子与银离子反应生成不溶于硝酸的氯化银沉淀,所以检验氯离子方法为:取少量试样溶于水后,再滴加硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
故答案为:硝酸酸化的硝酸银溶液;
(6)氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来,故a正确;通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度所以选项c正确,选项b错误,
故答案为:ac.
点评 本题以侯氏制碱工业为载体考查物质的制备,明确侯氏制碱法原理,明确流程图中发生的反应、物质分离提纯方法是解本题关键,侧重考查学生分析判断能力,注意向氯化钠溶液中通入氨气和二氧化碳的先后顺序.

| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
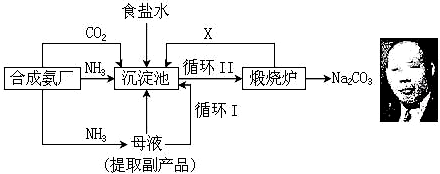
①工业合成氨时,通常采用以铁为主的催化剂,在温度为℃和压强为400~500、10~30MPa的条件下合成.
②沉淀池中发生反应的化学方程式NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
③上述流程中可循环利用的物质为NH3、CO2(填化学式),副产品为NH4Cl(填化学式).
④与氨碱法生产纯碱比较,侯氏制碱法有什么优点?综合利用原料(氯化钠的利用率提高到了96%)、降低成本、减少环境污染.
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度(g/100g水)表
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
为控制此温度范围,通常采取的加热方法为水浴加热.
⑥保温30分钟,静置后只析出NaHCO3晶体的原因相同温度下,碳酸氢钠的溶解度小.
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |

| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在t℃时,AgCl(s)+Br-(aq)═AgBr(s)+Cl-(aq)的平衡常数 K≈816 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点 |
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
| A. | 乙中的热化学方程式为2C(g)?A(g)+3B(g);△H=+4Q2/3kJ/mol | |
| B. | 反应达到平衡前,甲中始终有v正大于v逆,乙中始终有v正大于v逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为9×1.52(mol/L)2 | |
| D. | 乙中C的转化率为25% |