题目内容
3.有人常用废旧报纸包装食品,这是极不卫生的.原因是报纸上除含有多种病菌外,还会含有易使人中毒的多氯联苯和( )| A. | 铅 | B. | 机油 | C. | 三氯化锑 | D. | 硫 |
分析 根据已有的知识进行分析,原因是报纸上除含有多种病菌外,还会含有易使人中毒的多氯联苯,印刷时使用的油墨中含有铅元素,铅对人体有害.
解答 解:印刷书报的油墨中含有的铅元素,铅对人体有害,不能用来包装食品.
故选A.
点评 本题考查了物质中所含有的元素以及一些重金属元素,完成此题,可以依据已有的生活知识进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中.“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物属于下列分散系中的( )
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
14.可逆反应A(g)+3B(g)?2C(g)+2D(g),在四种不同情况下的反应速率分别如下,其中反应速率最大的是( )
| A. | VA=0.15 mol•L-1•min-1 | B. | VC=0.6 mol•L-1•min-1 | ||
| C. | VB=0.6 mol•L-1•min-1 | D. | VD=0.1 mol•L-1•min-1 |
11.下列依据热化学方程式得出的结论正确的是( )
| A. | 若2CH3OH(1)+3O2(g)═2CO2(g)+2H2O(g)△H=-1478KJ/mol,则CH3OH(1)的燃烧热为739KJ/mol | |
| B. | 若P4(白磷,s)═4P(红磷,s)△H<0,则红磷比白磷稳定 | |
| C. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3KJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.65KJ的热量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1; 2C(s)+O2(g)=2CO(g)△H2;△H1>△H2 |
18.下列离子方程式书写正确的是( )
| A. | 氢氧化钠溶液和稀盐酸反应:H++OH-═H2O | |
| B. | 大理石与盐酸反应制取二氧化碳:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁粉投入盐酸溶液中:2Fe+6H+═Fe3++3H2↑ | |
| D. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
5.(1)应用氨厂生产的氨气,侯德榜设计了侯氏制碱法,其生产流程如下:
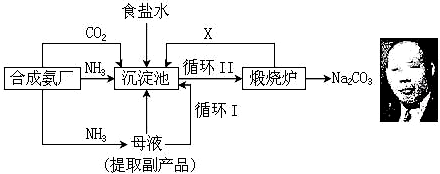
①工业合成氨时,通常采用以铁为主的催化剂,在温度为℃和压强为400~500、10~30MPa的条件下合成.
②沉淀池中发生反应的化学方程式NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
③上述流程中可循环利用的物质为NH3、CO2(填化学式),副产品为NH4Cl(填化学式).
④与氨碱法生产纯碱比较,侯氏制碱法有什么优点?综合利用原料(氯化钠的利用率提高到了96%)、降低成本、减少环境污染.
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度(g/100g水)表
⑤反应温度需要控制在30-35℃,原因是温度高于35℃时碳酸氢铵受热分解剧烈,温度低于30℃又减慢了化学反应的速率;
为控制此温度范围,通常采取的加热方法为水浴加热.
⑥保温30分钟,静置后只析出NaHCO3晶体的原因相同温度下,碳酸氢钠的溶解度小.

①工业合成氨时,通常采用以铁为主的催化剂,在温度为℃和压强为400~500、10~30MPa的条件下合成.
②沉淀池中发生反应的化学方程式NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
③上述流程中可循环利用的物质为NH3、CO2(填化学式),副产品为NH4Cl(填化学式).
④与氨碱法生产纯碱比较,侯氏制碱法有什么优点?综合利用原料(氯化钠的利用率提高到了96%)、降低成本、减少环境污染.
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度(g/100g水)表
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
为控制此温度范围,通常采取的加热方法为水浴加热.
⑥保温30分钟,静置后只析出NaHCO3晶体的原因相同温度下,碳酸氢钠的溶解度小.
12.表是0.1mol/L的部分阳离子常温下以氢氧化物形式沉淀时溶液的pH:
判断下列说法中正确的是( )
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
| A. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,滴加氢氧化钠溶液时Fe2+先产生沉淀 | |
| B. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,若除去混合溶液中的Fe2+、Fe3+,可先加入稀硝酸,再加入氧化铜调节溶液的pH的范围为3.2-4.7 | |
| C. | 相同温度下,Ksp[(Cu(OH)2)>Ksp[(Fe(OH)2) | |
| D. | 在含有Fe2+、Fe3+、Cu2+的混合溶液中,除去混合溶液中的Fe2+、Fe3+,可加入足量的铁粉 |
9.对于已达到平衡的可逆反应:A(g)?2B(?)+C(g)△H>0,假设A、C状态保持不变,下列说法正确的是( )
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
10.氨碱法(索氏)和联合制碱法(侯氏)是两大重要的工业制碱法,下列表达正确的是( )
| 氨碱法 | 联合制碱法 | ||
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氯化钠 |
| D. | 评价 | 原料易得;设备复杂;能耗高 | 原料利用率高;废弃物少 |
| A. | A | B. | B | C. | C | D. | D |