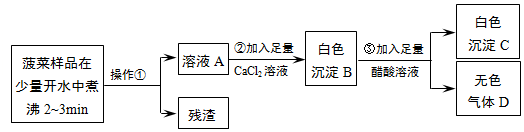
题目内容
6.下列离子方程式错误的是( )| A. | 氨气通入稀硫酸 NH3+H+═NH4+ | |
| B. | 稀烧碱溶液和氯化铵溶液混合 NH4++OH-═NH3•H2O | |
| C. | 碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH-═NH3↑+H2O | |
| D. | Cl2和水反应 Cl2+H2O═H++Cl-+HClO |
分析 A.氨气和稀硫酸反应生成硫酸铵;
B.稀氢氧化钠溶液和氯化铵反应生成氯化钠和一水合氨;
C.碳酸氢铵和足量浓氢氧化钠溶液混合加热,生成碳酸钠、氨气和水;
D.氯气和水反应生成盐酸和次氯酸.
解答 解:A.氨气和稀硫酸反应生成硫酸铵,离子方程式为NH3+H+=NH4+,故A正确;
B.稀氢氧化钠溶液和氯化铵反应生成氯化钠和一水合氨,离子方程式为NH4++OH-=NH3•H2O,故B正确;
C.碳酸氢铵和足量浓氢氧化钠溶液混合加热生成碳酸钠、氨气和水,离子方程式为NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+H2O+NH3↑,故C错误;
D.氯气和水反应生成盐酸和次氯酸,离子方程式为Cl2+H2O?H++Cl-+HClO,故D正确;
故选C.
点评 本题考查了离子方程式的书写,明确离子方程式书写规则及发生的反应是解本题关键,注意BC选项的区别,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
7.已知常温下,HA的电离平衡常数Ka=6.25×10-5,H2CO3的电离平衡常数Ka1=4.17×10-7、Ka2=4.90×10 -11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法不正确的是(不考虑饮料中其他成分)( )
| A. | 相同物质的量浓度的NaA、HA混合溶液呈碱性 | |
| B. | 提高CO2兖气压力,碳酸饮料中c (A-)减小 | |
| C. | 当碳酸饮料的pH为5.0时,$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3-)+2c( CO32-)+c(OH-)-c(HA) |
8.按碳骨架分类,下对说法正确的是( )
| A. | 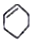 属于芳香族化合物 属于芳香族化合物 | B. | 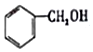 属于酚类化合物 属于酚类化合物 | ||
| C. | 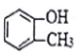 属于脂环化合物 属于脂环化合物 | D. | CH3CH2CH(CH3)2属于链状化合物 |
11.下列溶液一定呈中性的是( )
| A. | 不含OH-的溶液 | B. | 使酚酞试剂呈无色的溶液 | ||
| C. | pH=7的溶液 | D. | c(H+)=$\sqrt{{K}_{w}}$的溶液 |
18.将少量铝粉加入某溶液中有氢气放出,则该溶液中一定能大量共存的离子组是( )
| A. | K-、Ba2+、NO3-、SO32- | B. | NH4+、Al3+、Cl-、SO42- | ||
| C. | K Na2+[Al(OH)4]-、SO42- | D. | Na+、K+、SO42-、Br- |
15.下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
| A. | NH3和HCl | B. | CO2和SiO2 | C. | Ar和Al | D. | CCl4和NH4Cl |
16.有6种物质:①乙烷;②丙炔;③环己烯;④苯;⑤甲苯;⑥聚乙烯.其中常温下,既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
| A. | ①③④ | B. | ①④⑥ | C. | ①④⑤ | D. | ②③⑤ |