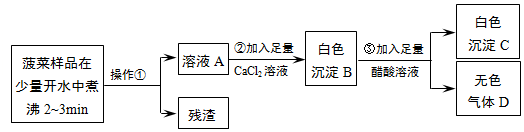
题目内容
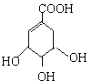
2.苯氧乙酸( )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是 、
、 、
、 任意2种(写出任意2种的结构简式)
任意2种(写出任意2种的结构简式)
分析 苯氧乙酸( ) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,据此书写.
) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,据此书写.
解答 解:苯氧乙酸( ) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,所以其同分异构体是:
) 的同分异构体符合:含有酯基;能与FeCl3溶液发生显色反应,说明含有酚羟基;且苯环上有2种一硝基取代物,苯环上有2个取代基且处于对位位置,所以其同分异构体是: 、
、 、
、 ,
,
故答案为: 、
、 、
、 任意2种.
任意2种.
点评 本题考查有机物的结构与性质,侧重分析能力、推断能力的综合考查,把握酚的性质、酯化反应等为解答的关键,题目难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
13.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA | |
| B. | 标准状况下,4.48L氦气中所含原子数为0.2NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 带温下,l.7gNH3和3.65gHCl混合后,气体分子数为0.2NA |
17.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | l mol羟基含有的电子数为9NA | |
| B. | 常温下,l mol乙烯和乙硼烷(B2H6)的混合气体所含的电子数为16NA | |
| C. | l mol苯乙烯中含有的碳碳双键数为4NA | |
| D. | 26 g乙炔和苯蒸气的混合气体中所含的碳原子数为2NA |
7.已知常温下,HA的电离平衡常数Ka=6.25×10-5,H2CO3的电离平衡常数Ka1=4.17×10-7、Ka2=4.90×10 -11.在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体.下列说法不正确的是(不考虑饮料中其他成分)( )
| A. | 相同物质的量浓度的NaA、HA混合溶液呈碱性 | |
| B. | 提高CO2兖气压力,碳酸饮料中c (A-)减小 | |
| C. | 当碳酸饮料的pH为5.0时,$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各粒子的浓度关系为c( H+)=c( HCO3-)+2c( CO32-)+c(OH-)-c(HA) |
14.下列说法正确的是( )
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 向苯酚钠溶液中通入少量CO2,溶液变浑浊,反应为:2C6H5ONa+CO2→2C6H5OH+Na2CO3 |
11.向含有等物质的量浓度的NaBr、KI、NaCl的混合液中通入足量的氯气,充分反应后将溶液蒸干,并灼烧所得的固体,最后剩余的固体成分可能是( )
| A. | KCl、Br2 | B. | NaCl、KCl | C. | KI、NaCl | D. | NaCl、KCl、I2 |
 (提示:环丁烷
(提示:环丁烷 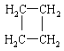 可简写成□)
可简写成□)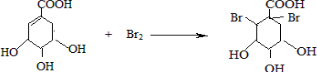 ,
,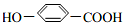 ),其反应类型是消去反应,
),其反应类型是消去反应,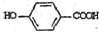 +2Br2→
+2Br2→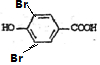 +2HBr.
+2HBr.