题目内容
14.下列有关叙述正确的是( )| A. | 丁达尔现象是化学变化 | |
| B. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| C. | 定容时,因不慎使液面高于容量瓶的刻度线,需重新配制 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电 |
分析 A.丁达尔现象没有新物质生成;
B.钠和溶液反应时先和水反应;
C.定容时,因不慎使液面高于容量的刻度线,要重新配置;
D.胶体不带电荷.
解答 解:A.丁达尔现象没有新物质生成,属于物理变化,故A错误;
B.钠投入硫酸铜溶液中时,先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜和硫酸钠,所以得不到金属铜,故B错误;
C.定容时,因不慎使液面高于容量的刻度线,如果滴管将多余液体吸出会导致溶质物质的量减少,所以配制溶液浓度偏低,则要重新配置,故C正确;
D.胶体本身不带电荷,但胶体具有吸附性,吸附离子致使胶体微粒带有电荷,故D错误.
故选C.
点评 本题考查了胶体性质分析判断,主要是分散系组成和稳定性的分析,掌握基础是关键,题目较简单.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案
相关题目
5.下列各组物质中,互为同系物的是( )
| A. | CH2=CHCH2CH3和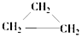 | B. |  和 和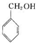 | ||
| C. | 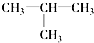 和CH3CH2CH2CH3 和CH3CH2CH2CH3 | D. | CH3CH2Cl与CH3CH2CH2Cl |
2.下列离子方程式与所述事实相符且书写正确的是( )
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 高锰酸钾在酸性介质中与草酸反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8 H2O | |
| C. | FeCl2与K3[Fe(CN)6]反应:2Fe2++3[Fe(CN)6]3-═Fe2[Fe(CN)6]3↓ | |
| D. | 向KI和H2SO4的混合溶液中通入空气:4H++4I-+O2=2I2+2H2O |
19.将7g某铜、银合金与足量的a mol/L HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全吸收,则此合金中铜的质量是( )
| A. | 1.6 g | B. | 2.4 g | C. | 3.2 g | D. | 4.8 g |
6.将一定质量的Al2O3固体投入100mL浓度为2mol/L的盐酸溶液中得到无色透明的澄清溶液,继续向所得溶液里加入物质的量浓度1mol/L的NaOH溶液,当沉淀达到最大时,加入NaOH溶液的体积是( )
| A. | 50 mL | B. | 100 mL | C. | 200 mL | D. | 300 mL |
3.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+、K+等8种离子中的某几种.取该溶液进行实验,得到如下现象:( )
①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中存在的离子组可能是.
①向溶液中滴加过量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.
据此可以推断:该溶液中存在的离子组可能是.
| A. | Al3+、Mg2+、SO32- | B. | K+、CO32-、I- | C. | Al3+、CO32-、I- | D. | Na+、Br-、CO32- |
4.如表是元素周期表的前四周期:
回答下列问题:
(1)G元素与E元素形成的化合物的化学式可能是Na2O、Na2O2,I与J的原子序数相差为18.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(用化合物的化学式表示,下同),酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+(用离子符号回答).
| I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | |||||
| 四 | J |
(1)G元素与E元素形成的化合物的化学式可能是Na2O、Na2O2,I与J的原子序数相差为18.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是NaOH(用化合物的化学式表示,下同),酸性最强的是HClO4,E、F、G三种元素形成的简单离子半径由大到小的顺序是O2->F->Na+(用离子符号回答).