题目内容
有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中A为非金属元素;A和E属同一族,它们原子最外层电子排布为ns1.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:
(1)B是 ,E是 .(请写元素符号)
(2)由这五种元素组成的一种化合物是(写化学式) .写出该物质的一种主要用途: .
(3)写出C元素基态原子的电子排布式: .
(4)用电子排布图表示D元素原子的价电子排布为 .
(5)元素B与D的电负性的大小关系是B D,C与E的第一电离能的大小关系是C E.(填“>”、“<”或“=”)
(1)B是
(2)由这五种元素组成的一种化合物是(写化学式)
(3)写出C元素基态原子的电子排布式:
(4)用电子排布图表示D元素原子的价电子排布为
(5)元素B与D的电负性的大小关系是B
考点:位置结构性质的相互关系应用,原子核外电子排布,元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素,A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,A为非金属元素,故A为H元素,E的原子序数大于S元素,故E为K元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数介于O与S之间,故C为Al元素,据此答题;
解答:
解:A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,故最外层电子排布为ns2np4,故B为O元素,D为S元素,A和E元素原子的最外层电子排布为ns1,处于第ⅠA族,A为非金属元素,故A为H元素,E的原子序数大于S元素,故E为K元素,C原子最外层上电子数等于D原子最外层上电子数的一半,故C原子最外层电子数为3,原子序数介于O与S之间,故C为Al元素,则:
(1)由以上分析可知,B为O,E为K,
故答案为:O;K;
(2)由H、O、Al、S、K五种元素组成的一种化合物是KAlSO4?12H2O,可以用作净水剂,
故答案为:KAlSO4?12H2O;净水剂;
(3)C为Al原子,基态原子的电子排布式为:1s22s22p63s23p1,
故答案为:1s22s22p63s23p1;
(4)D为S元素,原子价层电子排布为ns2np4,轨道表示式为 ,
,
故答案为: ;
;
(5)同主族自上而下电负性降低,故电负性O>S,金属性越强,第一电离能越小,故第一电离能Al>K,
故答案为:>;>.
(1)由以上分析可知,B为O,E为K,
故答案为:O;K;
(2)由H、O、Al、S、K五种元素组成的一种化合物是KAlSO4?12H2O,可以用作净水剂,
故答案为:KAlSO4?12H2O;净水剂;
(3)C为Al原子,基态原子的电子排布式为:1s22s22p63s23p1,
故答案为:1s22s22p63s23p1;
(4)D为S元素,原子价层电子排布为ns2np4,轨道表示式为
 ,
,故答案为:
 ;
;(5)同主族自上而下电负性降低,故电负性O>S,金属性越强,第一电离能越小,故第一电离能Al>K,
故答案为:>;>.
点评:本题考查结构位置与性质关系、核外电子排布规律、元素周期律等,难度中等,推断元素是解题的关键,B和D的最外层电子排布是推断突破口.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
由CO2、N2 和 CO 组成的混合气体在同温、同压下与氧气的密度相同.则该混合气体中CO2、N2 和CO 的体积比为( )
| A、2:1:1 |
| B、2:2:4 |
| C、1:2:2 |
| D、2:3:2 |
取一定量的NH4NO3和(NH4)2SO4固体混合物,分成质量相等的两等份.一份与足量的NaOH浓溶液共热,在标准状况下收集到6.72L NH3;另一份加水完全溶解后,加入过量的BaCl2溶液得到11.65g白色沉淀.下列说法错误的是( )
| A、原固体混合中n[(NH4)2SO4]=0.05 mol |
| B、原固体混合中m(NH4NO3)=16 g |
| C、若完全溶解后溶液的体积为100 mL,则c(NH4NO3)=4 mol?L-1 |
| D、原固体混合中n(NH4NO3):n[(NH4)2SO4]=4:1 |
已知NaHCO3在150℃下会发生分解反应:2NaHCO3
Na2CO3+CO2↑+H2O,则反应生成的混合气体对氢气的相对密度是( )
| ||
| A、15.5 | B、42 |
| C、31 | D、21 |
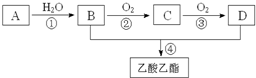 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.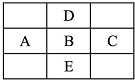 如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子.
如图是周期表的一部分,A、B、C、D、E五种元素的原子核共含有80个质子. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.