题目内容
某学生用邻苯二甲酸氢钾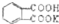 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
已知: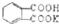 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
(1)写出邻苯二甲酸氢钾的分子式: ,它 (填“属于”或“不属于”)烃.
(2)滴定终点的现象: .
(3)NaOH溶液的物质的量浓度: .
(4)该学生测定出来的NaOH溶液的物质的量浓度高于其实际值,造成该结果的原因可能是 .
A.盛放邻苯二甲酸氢钾的锥形瓶未用待装液润洗
B.读消耗NaOH溶液的体积时,滴定前仰视,滴定后俯视
C.滴速太快没来得及观察就已经变色
D.配制NaOH溶液时,NaOH固体中可能混有KOH.
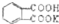 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:| 实验编号 | 邻苯二甲酸氢钾质量(g) | 待测NaOH溶液体积(mL) |
| l | 0.2040 | 23.20 |
| 2 | 0.2040 | 19.95 |
| 3 | 0.2040 | 20.05 |
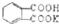 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.(1)写出邻苯二甲酸氢钾的分子式:
(2)滴定终点的现象:
(3)NaOH溶液的物质的量浓度:
(4)该学生测定出来的NaOH溶液的物质的量浓度高于其实际值,造成该结果的原因可能是
A.盛放邻苯二甲酸氢钾的锥形瓶未用待装液润洗
B.读消耗NaOH溶液的体积时,滴定前仰视,滴定后俯视
C.滴速太快没来得及观察就已经变色
D.配制NaOH溶液时,NaOH固体中可能混有KOH.
考点:中和滴定
专题:实验题
分析:(1)根据邻苯二甲酸氢钾的结构式写出分子式;烃是指仅含碳氢两种元素的化合物;
(2)根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
(3)邻苯二甲酸氢钾的质量求出物质的量,邻苯二甲酸氢钾与氢氧化钠按1:1反应求出氢氧化钠,根据溶液体积求出物质的量浓度;
(4)根据c(待测)=
进行误差分析.
(2)根据指示剂在不同的酸碱性溶液显示不同的颜色判断;
(3)邻苯二甲酸氢钾的质量求出物质的量,邻苯二甲酸氢钾与氢氧化钠按1:1反应求出氢氧化钠,根据溶液体积求出物质的量浓度;
(4)根据c(待测)=
| c(标准)V(标准) |
| V(待测) |
解答:
解:(1)邻苯二甲酸氢钾的分子式为C8H5O4K;它不属于烃;
故答案为:C8H5O4K;烃;
(2)酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:无色溶液变成浅红色,且半分钟内不褪色;
(3)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,n(邻苯二甲酸氢钾)=
=0.001mol,待测NaOH溶液体积第一组数据无效,则V(NaOH)=
×10-3L=0.02L
所以氢氧化钠溶液物质的量浓度为c(NaOH)=
=0.05mol/L,
故答案为:0.05mol/L;
(4)A.盛放邻苯二甲酸氢钾的锥形瓶未用待装液润洗,对滴定结果无影响,故A不符合;
B.读消耗NaOH溶液的体积时,滴定前仰视,滴定后俯视,消耗的溶液体积增大,测定结果偏高,故B符合;
C.滴速太快没来得及观察就已经变色,消耗的溶液体积偏小,测定结果偏低,故C不符合;
D.等质量的氢氧化钠消耗的邻苯二甲酸氢钾溶液的体积大于等质量KOH消耗消耗的邻苯二甲酸氢钾溶液的体积,配制NaOH溶液时,NaOH固体中可能混有KOH,消耗的溶液体积偏小,测定结果偏低,故D不符合;
故选B;
故答案为:C8H5O4K;烃;
(2)酚酞在pH<8时为无色,pH为8~10之间,呈浅红色,所以当无色溶液变成浅红色,且半分钟内不褪色,说明反应到终点,
故答案为:无色溶液变成浅红色,且半分钟内不褪色;
(3)邻苯二甲酸氢钾,分子内有1个羧基,所以邻苯二甲酸氢钾与氢氧化钠按1:1反应,即邻苯二甲酸氢钾与氢氧化钠的物质的量相等,n(邻苯二甲酸氢钾)=
| 0.2040g |
| 204g/mol |
| 19.95+20.05 |
| 2 |
所以氢氧化钠溶液物质的量浓度为c(NaOH)=
| 0.001mol |
| 0.02L |
故答案为:0.05mol/L;
(4)A.盛放邻苯二甲酸氢钾的锥形瓶未用待装液润洗,对滴定结果无影响,故A不符合;
B.读消耗NaOH溶液的体积时,滴定前仰视,滴定后俯视,消耗的溶液体积增大,测定结果偏高,故B符合;
C.滴速太快没来得及观察就已经变色,消耗的溶液体积偏小,测定结果偏低,故C不符合;
D.等质量的氢氧化钠消耗的邻苯二甲酸氢钾溶液的体积大于等质量KOH消耗消耗的邻苯二甲酸氢钾溶液的体积,配制NaOH溶液时,NaOH固体中可能混有KOH,消耗的溶液体积偏小,测定结果偏低,故D不符合;
故选B;
点评:本题考查了中和滴定,滴定实验的过程分析和计算应用,注意实验基本操作的理解应用,掌握基础和实验基本操作是解题关键,题目难度中等.

练习册系列答案
相关题目
NA代表阿伏加德罗常数的值下列有关叙述正确的是( )
| A、5.6g铁粉在2.24L氯气中充分燃烧,失去的电子数一定为0.3NA |
| B、标准状况下,15g一氧化氮和5.6L氧气混合后的分子总数为0.5NA |
| C、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、78gNa2S和Na2O2的混合物中含有的离子总数大于3NA |
将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
| A、硫酸、纯碱、氯化钙 |
| B、盐酸、烧碱、硫酸铜 |
| C、碳酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钾 |
取100mL 1.0mol?L-1和200mL 2.0mol?L-1的盐酸混合后,全部注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A、0.5 mol?L-1 |
| B、2.0 mol?L-1 |
| C、1.5.mol?L-1 |
| D、1.0 mol?L-1 |
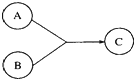 Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1molA能与1molNaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题,
Ⅰ有机物A、B、C有如图所示转化关系,A的分子式为C3H4O2,A可与溴的四氯化碳溶液发生加成反应,1molA能与1molNaHCO3溶液恰好完全反应.B所含元素种类与A相同,是厨房的调味品,其中碳的质量分数为52.2%,氢的质量分数为13%.试回答下列问题,
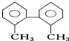
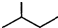 的名称为
的名称为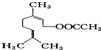
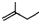
 最多
最多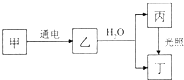 甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为黄绿色气体单质,它们之间有如图所示的转化关系(转化过程中部分产物未标出).
甲、乙、丙、丁4种物质均含A元素,其中甲的焰色反应呈黄色,乙为黄绿色气体单质,它们之间有如图所示的转化关系(转化过程中部分产物未标出).