题目内容
在反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,试从氧化还原与元素化合价的升降的角度分析上述反应,并回答下列问题:
(1)就在上面方程式中用双线桥法标出该反应中电子转移的方向和数目 .
(2) 是氧化剂 是氧化产物.在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与参加非氧化还原反应的HCl的质量比为 .
(3)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是 ;R的相对原子质量是 .
(1)就在上面方程式中用双线桥法标出该反应中电子转移的方向和数目
(2)
(3)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)该反应中Mn元素化合价由+7价变为+2价、部分Cl元素化合价由-1价变为0价,其转移电子总数为10;
(2)得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
根据元素化合价是否变化知,参加反应的HCl中作还原剂和参加非氧化还原反应的HCl的物质的量之比为5:3,根据m=nM计算其质量之比;
(3)1.2gRSO4中含0.01mol R2+,根据物质构成知n(RSO4)=n(R2+)=0.01mol,则M(RSO4)=
=120g/mol,R摩尔质量=120g/mol-96g/mol=24g/mol,摩尔质量在数值上等于其相对原子质量.
(2)得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物;
根据元素化合价是否变化知,参加反应的HCl中作还原剂和参加非氧化还原反应的HCl的物质的量之比为5:3,根据m=nM计算其质量之比;
(3)1.2gRSO4中含0.01mol R2+,根据物质构成知n(RSO4)=n(R2+)=0.01mol,则M(RSO4)=
| 1.2g |
| 0.01mol |
解答:
解:(1)该反应中Mn元素化合价由+7价变为+2价、部分Cl元素化合价由-1价变为0价,其转移电子总数为10,所以其转移电子方向和数目为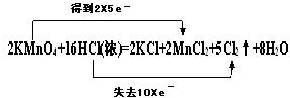 ,故答案为:
,故答案为: ;
;
(2)根据(1)知,KMnO4得电子是氧化剂、部分HCl失电子是还原剂,氧化产物是Cl2,
根据元素化合价是否变化知,参加反应的HCl中作还原剂和参加非氧化还原反应的HCl的物质的量之比为5:3,二者的摩尔质量相等,根据m=nM知其质量之比等于物质的量之比,所以其质量之比为5:3;
故答案为:KMnO4;Cl2;
(3)1.2gRSO4中含0.01mol R2+,根据物质构成知n(RSO4)=n(R2+)=0.01mol,则M(RSO4)=
=120g/mol,R摩尔质量=120g/mol-96g/mol=24g/mol,摩尔质量在数值上等于其相对原子质量,所以R的相对原子质量为24,
故答案为:120g/mol; 24.
 ,故答案为:
,故答案为: ;
;(2)根据(1)知,KMnO4得电子是氧化剂、部分HCl失电子是还原剂,氧化产物是Cl2,
根据元素化合价是否变化知,参加反应的HCl中作还原剂和参加非氧化还原反应的HCl的物质的量之比为5:3,二者的摩尔质量相等,根据m=nM知其质量之比等于物质的量之比,所以其质量之比为5:3;
故答案为:KMnO4;Cl2;
(3)1.2gRSO4中含0.01mol R2+,根据物质构成知n(RSO4)=n(R2+)=0.01mol,则M(RSO4)=
| 1.2g |
| 0.01mol |
故答案为:120g/mol; 24.
点评:本题考查氧化还原反应,侧重考查物质的量的计算、基本概念,明确元素化合价变化及基本概念是解本题关键,注意该反应中HCl的作用,题目难度中等.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
往一体积不变的密闭容器中充入H2和I2,发生反应H2 (g)+I2 (g)?2HI(g)△H<0,当达到平衡后,t0时刻改变某一条件(混合气体量不变),容器内压强增大,下列说法正确的是( )
| A、可能为升温 |
| B、平衡一定不移动 |
| C、H2 转化率增大 |
| D、HI平衡浓度一定变大 |
已知反应FeO(s)+C(s)=CO(g)+Fe(s)的△H>0,(假设△H,△S不随温度变化而变化),下列叙述中正确的是( )
| A、低温下为自发过程,高温下为非自发过程 |
| B、高温下为自发过程,低温下为非自发过程 |
| C、任何温度下为非自发过程 |
| D、任何温度下为自发过程 |
下列分子中既有σ键又有π键的是( )
| A、Cl2 |
| B、HCl |
| C、H2O |
| D、N2 |
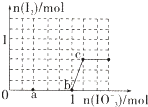 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是( )| A、还原性:HSO3->I-,氧化性:IO3->I2>SO42- |
| B、a点处的氧化产物是SO42-,还原产物是I- |
| C、当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol |
| D、若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2,+5SO42-+3H++H2O |
溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合均匀后,混合溶液中H2SO4的质量分数为( )
| A、30% | B、6a% |
| C、>3a% | D、<3a% |
 如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)
如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)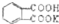 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表: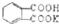 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.