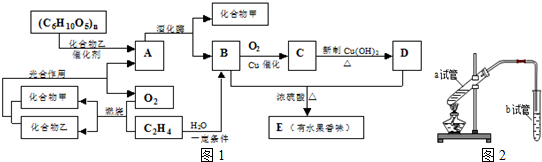
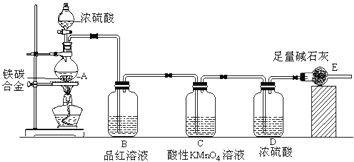
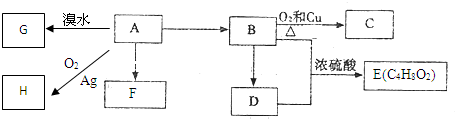
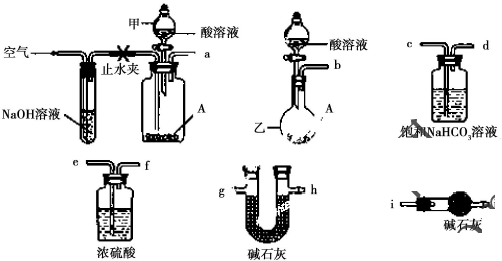
题目内容
取100mL 1.0mol?L-1和200mL 2.0mol?L-1的盐酸混合后,全部注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A、0.5 mol?L-1 |
| B、2.0 mol?L-1 |
| C、1.5.mol?L-1 |
| D、1.0 mol?L-1 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:混合稀释后溶液中HCl的物质的量等于100mL 1.0mol?L-1和200mL 2.0mol?L-1的盐酸溶液中含有的HCl之和,令混合稀释后HCl的物质的量浓度为a,根据n=cV计算混合稀释后的浓度,溶液中H+的物质的量浓度等于HCl的浓度.
解答:
解:令混合稀释后HCl的物质的量浓度为c,则:
0.1L×1.0mol?L-1+0.2L×2.0mol?L-1=0.5L×c,
解得:c=1mol/L,
故选D.
0.1L×1.0mol?L-1+0.2L×2.0mol?L-1=0.5L×c,
解得:c=1mol/L,
故选D.
点评:本题考查了物质的量浓度计算,题目难度不大,注意掌握物质的量浓度概念及计算方法,明确氢离子与溶质盐酸的组成关系及稀释过程中溶质的物质的量不变.注意对公式的理解与灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
溶质质量分数分别为a%和5a%的H2SO4溶液按等体积混合均匀后,混合溶液中H2SO4的质量分数为( )
| A、30% | B、6a% |
| C、>3a% | D、<3a% |
决定气体体积的因素是:①气体分子的直径 ②气体的物质的量多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
| A、①② | B、①③ | C、②③ | D、②④ |
将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:NH4Br(s)═NH3(g)+HBr(g),2HBr(g)fBr2(g)+H2(g).两分钟后,反应达到化学平衡,测知H2浓度为0.5mol?L-1,HBr的浓度为4mol?L-1,若上述反应速率用v(NH3)表示,下列速率正确的是( )
| A、0.5 mol?L-1?min-1 |
| B、2.5 mol?L-1?min-1 |
| C、2 mol?L-1?min-1 |
| D、5 mol?L-1?min-1 |
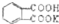 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表: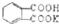 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.