题目内容
NA代表阿伏加德罗常数的值下列有关叙述正确的是( )
| A、5.6g铁粉在2.24L氯气中充分燃烧,失去的电子数一定为0.3NA |
| B、标准状况下,15g一氧化氮和5.6L氧气混合后的分子总数为0.5NA |
| C、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA |
| D、78gNa2S和Na2O2的混合物中含有的离子总数大于3NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、氯气所处的状态不明确;
B、标准状况下,1mol任何气体中含有的分子数为1NA;
C、先计算甲烷和水的物质的量,再计算出电子数进行比较;
D、硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子.
B、标准状况下,1mol任何气体中含有的分子数为1NA;
C、先计算甲烷和水的物质的量,再计算出电子数进行比较;
D、硫化钠和过氧化钠的摩尔质量相等,1mol过氧化钠中含有1mol阴离子.
解答:
解:A、氯气所处的状态不明确,故2.24L氯气的物质的量不一定是0.1mol,故A错误;
B、标准状况下,15g(0.5mol)一氧化氮和5.6L(0.25mol)氧气混合后发生反应生成0.5mol的二氧化氮,但生成的二氧化氮又能生成四氧化二氮,二者的反应为可逆反应,则分子的总物质的量小于0.5mol,分子数小于0.5NA,故B错误;
C、标况下,22.4L甲烷的物质的量是1mol,含有10mol电子,18g水物质的量是1mol,含有10mol电子,所含有的电子数均为10NA,故C正确;
D、1mol过氧化钠中含有1mol阴离子,78g Na2S和Na2O2的混合物的物质的量为1mol,含有的阴离子数等于1NA,故D错误;
故选C.
B、标准状况下,15g(0.5mol)一氧化氮和5.6L(0.25mol)氧气混合后发生反应生成0.5mol的二氧化氮,但生成的二氧化氮又能生成四氧化二氮,二者的反应为可逆反应,则分子的总物质的量小于0.5mol,分子数小于0.5NA,故B错误;
C、标况下,22.4L甲烷的物质的量是1mol,含有10mol电子,18g水物质的量是1mol,含有10mol电子,所含有的电子数均为10NA,故C正确;
D、1mol过氧化钠中含有1mol阴离子,78g Na2S和Na2O2的混合物的物质的量为1mol,含有的阴离子数等于1NA,故D错误;
故选C.
点评:阿伏伽德罗常数有关的计算,题目在注重对计算关系的考查的同时,又隐含对物质状态、物质结构等知识的考查.

练习册系列答案
相关题目
已知反应FeO(s)+C(s)=CO(g)+Fe(s)的△H>0,(假设△H,△S不随温度变化而变化),下列叙述中正确的是( )
| A、低温下为自发过程,高温下为非自发过程 |
| B、高温下为自发过程,低温下为非自发过程 |
| C、任何温度下为非自发过程 |
| D、任何温度下为自发过程 |
同温同压下,等质量的O2和O3,对于二者的说法错误的是( )
| A、物质的量之比3:2 |
| B、原子数之比为1:1 |
| C、体积之比为 2:3 |
| D、质子数之比1:1 |
决定气体体积的因素是:①气体分子的直径 ②气体的物质的量多少 ③气体分子间的平均距离 ④气体分子的相对分子质量( )
| A、①② | B、①③ | C、②③ | D、②④ |
下列电离方程式书写正确的是( )
| A、H2CO3=2 H++CO32- |
| B、Ca(OH)2=Ca2++(OH)2- |
| C、K2SO4═2K++SO4-2 |
| D、NaHCO3=Na++HCO3- |
立方烷、棱晶烷和盆烯是近年来运用有机合成方法制备的具有如下图所示立体结构的环状有机物,对上述有机物的说法正确的是( )

| A、立方烷、棱晶烷和盆烯都不能使溴水褪色 |
| B、棱晶烷和盆烯互为同分异构体 |
| C、立方烷的二氯代物共有3种 |
| D、立方烷、棱晶烷中C原子都形成4个单键,因此它们都属于烷烃 |
 如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)
如图是给病人输液用的氯化钠注射溶液的标签.(友情提示:若要用到溶液密度,可用水的密度进行计算)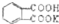 测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表:
测定NaOH溶液的浓度.若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表: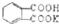 的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.
的式量为204.0,且1mol邻苯二甲酸氢钾能与1mol NaOH反应.