题目内容
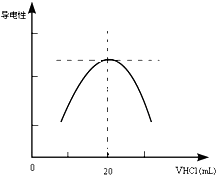 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统.如果锥形瓶中含有少量蒸馏水,是否会影响测量结果
(3)①滴定管盛放盐酸前,要先
②向锥形瓶中滴加0.10mol?L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图.写出氨水与盐酸反应的离子方程式
考点:中和滴定
专题:实验题
分析:(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(2)根据c(碱)=
判断不当操作对相关物理量的影响;
(3)①滴定管在使用前首先要检查是否漏水,然后用少量蒸馏水洗涤,最后用待装液润洗并将溶液的液面至凹液面的最低点处于滴定管的“0“刻度或“0“刻度以下;
②氨水与盐酸反应生成氯化铵和水.
(2)根据c(碱)=
| c(酸)×V(酸) |
| V(碱) |
(3)①滴定管在使用前首先要检查是否漏水,然后用少量蒸馏水洗涤,最后用待装液润洗并将溶液的液面至凹液面的最低点处于滴定管的“0“刻度或“0“刻度以下;
②氨水与盐酸反应生成氯化铵和水.
解答:
解:(1)配制步骤有计算、量取、溶解、冷却、移液、洗涤、定容、摇匀等操作,用10mL量筒量取10mL氨水样品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)如果锥形瓶中含有少量蒸馏水,虽然待测液的浓度减少,但物质的量不变,消耗的V(酸)不变,根据c(碱)=
判断c(碱)不变,
故答案为:否;
(3)①滴定管在使用前首先要检查是否漏水,然后用少量蒸馏水洗涤,最后用所要盛放的盐酸润洗2~3次;并将溶液的液面至凹液面的最低点处于滴定管的“0“刻度或“0“刻度以下;
故答案为:检查是否漏水;用所要盛放的盐酸润洗2~3次;“0“刻度或“0“刻度以下;
②氨水与盐酸反应生成盐和水,离子方程式为:H++NH3?H2O=NH4++H2O,故答案为:H++NH3?H2O=NH4++H2O.
故答案为:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)如果锥形瓶中含有少量蒸馏水,虽然待测液的浓度减少,但物质的量不变,消耗的V(酸)不变,根据c(碱)=
| c(酸)×V(酸) |
| V(碱) |
故答案为:否;
(3)①滴定管在使用前首先要检查是否漏水,然后用少量蒸馏水洗涤,最后用所要盛放的盐酸润洗2~3次;并将溶液的液面至凹液面的最低点处于滴定管的“0“刻度或“0“刻度以下;
故答案为:检查是否漏水;用所要盛放的盐酸润洗2~3次;“0“刻度或“0“刻度以下;
②氨水与盐酸反应生成盐和水,离子方程式为:H++NH3?H2O=NH4++H2O,故答案为:H++NH3?H2O=NH4++H2O.
点评:本题主要考查了中和滴定的操作过程,掌握误差分析的原理是解题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.判断下列说法正确的是( )
反应A:4HCl+O2
2Cl2+2H2O
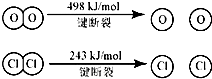
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、
反应A:4HCl+O2
| CuO?CuCl2 |
| 400℃ |
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、

| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子.下列说法正确的是( )
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |
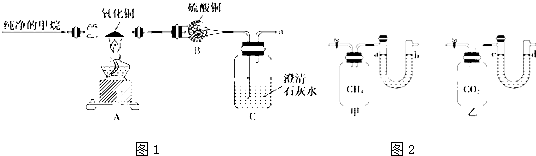
 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题: