题目内容
下列无机含氧酸酸性最弱的是( )
| A、HClO |
| B、H3PO4 |
| C、HNO3 |
| D、HClO4 |
考点:物质的结构与性质之间的关系
专题:
分析:含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,将选项中含氧酸改写成XOm(OH)n形式,根据非羟基氧原子数目判断.
解答:
解:A、HClO可以改写为Cl(OH)1,非羟基氧原子数目为0;
B、H3PO4可以改写为PO1(OH)3,非羟基氧原子数目为1;
C、HNO3可以为NO2(OH)1,非羟基氧原子数目为2;
D、HClO4可以改写为ClO3(OH)1,非羟基氧原子数目为3;
HClO中非羟基氧原子数目最少,酸性最弱,
故选A.
B、H3PO4可以改写为PO1(OH)3,非羟基氧原子数目为1;
C、HNO3可以为NO2(OH)1,非羟基氧原子数目为2;
D、HClO4可以改写为ClO3(OH)1,非羟基氧原子数目为3;
HClO中非羟基氧原子数目最少,酸性最弱,
故选A.
点评:本题考查了酸性强弱比较,根据含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,非羟基氧原子数目越大,酸性越强进行判断,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
0.8g 某物质含有3.01×1022个分子,该物质的式量约为( )
| A、8 | B、16 | C、64 | D、160 |
在密闭容器中发生反应H2(g)+I2(g)?2HI(g),0~5min内H2的浓度减少了0.1mol/L,则在这段时间内
用HI表示的平均反应速率为( )
用HI表示的平均反应速率为( )
| A、0.01mol?L-1?min-1 |
| B、0.04mol?L-1?min-1 |
| C、0.2mol?L-1?min-1 |
| D、0.5mol?L-1?min-1 |
下列每组物质发生状态变化时所克服的微粒间的相互作用属于同种类型的是( )
| A、食盐和蔗糖熔化 |
| B、金刚石和硫熔化 |
| C、碘和干冰升华 |
| D、二氧化硅和氧化钠熔化 |
能用H++OH-=H2O来表示的化学反应是( )
| A、Mg(OH)2和稀盐酸反应 |
| B、Ba(OH)2溶液滴入稀H2SO4中 |
| C、KOH溶液和稀HNO3反应 |
| D、CO2通入Ca(OH)2溶液中 |
用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.判断下列说法正确的是( )
反应A:4HCl+O2
2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、
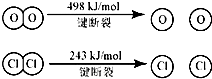
反应A:4HCl+O2
| CuO?CuCl2 |
| 400℃ |
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、

| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
下列大小比较正确的是( )
| A、离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na |
| D、酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
