题目内容
全部属于纯净物的组合是( )
| A、福尔马林、白酒、食醋 |
| B、汽油、油脂、酚醛树脂 |
| C、石碳酸、盐酸、冰醋酸 |
| D、甘油、乙醇钠、氯仿 |
考点:混合物和纯净物
专题:物质的分类专题
分析:纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分逐项分析即可.
解答:
解:A、福尔马林是甲醛的水溶液,溶质的质量分数为甲醛含量为35%至40%(一般是37%)的水溶液,故为混合物;白酒的主要成分是乙醇和水,为混合物;食醋主要成分其主要成分是醋酸(3%~5%),除此之外还含有各种有机酸、氨基酸等成分,故食醋为混合物,故A错误;
B、汽油,主要成分是 C 4 ~C 12 烃类,为混合烃类物品之一;油脂中由于烃基的不同,为混合物;酚醛树脂是混合物,故B错误;
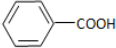
C、石炭酸又名苯酚,是纯净物;盐酸是HCl的水溶液,是混合物;冰醋酸是乙酸,为纯净物,故C错误;
D、甘油是丙三醇,是由一种物质组成的,属于纯净物;乙醇钠是由一种物质组成的,属于纯净物;氯仿是三氯甲烷,是由一种物质组成的,属于纯净物,故D正确.
故选D.
B、汽油,主要成分是 C 4 ~C 12 烃类,为混合烃类物品之一;油脂中由于烃基的不同,为混合物;酚醛树脂是混合物,故B错误;
C、石炭酸又名苯酚,是纯净物;盐酸是HCl的水溶液,是混合物;冰醋酸是乙酸,为纯净物,故C错误;
D、甘油是丙三醇,是由一种物质组成的,属于纯净物;乙醇钠是由一种物质组成的,属于纯净物;氯仿是三氯甲烷,是由一种物质组成的,属于纯净物,故D正确.
故选D.
点评:本题考查了纯净物和混合物的概念,把握住概念的要点是解题的关键.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
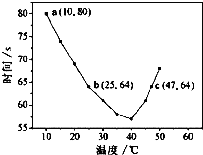 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
丙烯酸的结构简式为CH2=CH-COOH,对其性质的描述不正确的是( )
| A、能与金属钠反应放出氢气 |
| B、能发生加聚反应生成高分子化合物 |
| C、能与新制氢氧化铜反应 |
| D、能与溴水发生氧化反应使其褪色 |
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条看不到明显现象;关闭B阀后,C处红布逐渐褪色.则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条看不到明显现象;关闭B阀后,C处红布逐渐褪色.则D瓶中装的是( )| A、浓H2SO4 |
| B、NaOH溶液 |
| C、H2O |
| D、Na2S溶液 |
下列实验“操作和现象”与“结论”对应关系正确的是( )
| A、处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解/Ksp:CaCO3<CaSO4 |
| B、用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成/该电极为阳极 |
| C、向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出/氧化性:Cu2+>Fe3+ |
| D、向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成/该溶液中一定含有Ag+ |
下列实验操作(或目的)中错误的是( )
| A、加热蒸发实验的全过程中,一定不需要石棉网 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管出口处 |
| C、测量高锰酸钾分解率时,可以选坩埚、天平、玻璃棒等仪器 |
| D、称量操作时,应将被称量物质放于托盘天平的左盘 |
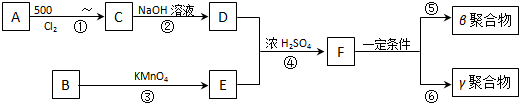
 ,
,