题目内容
在0.1mol/L的氨水中存在 NH3?H2O?NH4++OH-的电离平衡,下列措施都能使 该平衡向右移动的一组是( )
①加入少量HCl;②加入固体NaOH;③加水;④通入氨气;⑤加热升高温度;⑥加入NH4NO3.
①加入少量HCl;②加入固体NaOH;③加水;④通入氨气;⑤加热升高温度;⑥加入NH4NO3.
| A、①③④⑤ | B、①③④⑤⑥ |
| C、②③④⑤ | D、①③④⑥ |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:稀氨水中存在下述电离平衡:NH3+H2O?NH3?H2O?NH4++OH-,向氨水中加入物质后确定哪种微粒浓度增大,平衡就向减弱这种微粒的方向移动,从而确定平衡移动方向.
解答:
解:①加入少量HCl,会消耗氢氧根离子,促进平衡正向移动,故正确;
②加入固体NaOH,会增大氢氧根离子的浓度,平衡逆向移动,故错误;
③加水荟萃及电解质的电离,故正确;
④通入氨气,会增大反应物的浓度,平衡正向移动,故正确;
⑤氨水的电离是吸热的,加热升高温度,会促进电离,平衡右移,故正确;
⑥加入NH4NO3会增大铵根离子浓度,平衡逆向移动,故错误.
故选A.
②加入固体NaOH,会增大氢氧根离子的浓度,平衡逆向移动,故错误;
③加水荟萃及电解质的电离,故正确;
④通入氨气,会增大反应物的浓度,平衡正向移动,故正确;
⑤氨水的电离是吸热的,加热升高温度,会促进电离,平衡右移,故正确;
⑥加入NH4NO3会增大铵根离子浓度,平衡逆向移动,故错误.
故选A.
点评:本题考查了化学平衡、电离平衡的移动,根据勒夏特里原理来分析解答即可,难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
下列实验基本操作不规范的是( )
| A、点燃氢气之前必须检验氢气的纯度 |
| B、使用胶头滴管时,应使滴管始终垂直向下,一般不得伸入容器内 |
| C、用酒精灯给烧瓶中的液体加热时,无须垫石棉网 |
| D、使用托盘天平称量物质时,应先将游码拨到刻度尺最左端,然后调节螺母将天平调平衡 |
对于实验I?IV,预测正确的是( )


| A、实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B、实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色 |
| C、实验Ⅲ:从饱和食盐水中提取NaCl晶体 |
| D、装置Ⅳ:既可防止倒吸,又更加有利于SO2的充分吸收 |
 如图是元素周期表短周期的一部分,已知B原子与C原子核外电子总数和为A原子核外电子总数的4倍,则以下推断正确的是( )
如图是元素周期表短周期的一部分,已知B原子与C原子核外电子总数和为A原子核外电子总数的4倍,则以下推断正确的是( )| A、三者皆为非金属元素 |
| B、B与A、B与C均可以形成离子化合物 |
| C、三者核电荷数之和为40 |
| D、B与C只能形成一种共价化合物 |
如图实验现象预测或实验操作或实验原理正确的是( )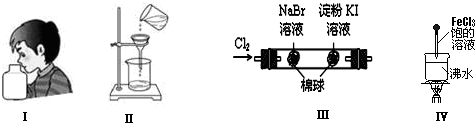

| A、实验Ⅰ:闻气味 |
| B、实验Ⅱ:过滤 |
| C、实验Ⅲ:左边的棉球呈橙色,右边的棉球呈蓝色,证明氧化性:Cl2>Br2>I2 |
| D、实验Ⅳ:当溶液至红褐色,停止加热,让光束通过体系时可产生丁达尔现象 |
标准状况下有①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①③②④ |
| B、密度:④①③② |
| C、质量:①④③② |
| D、氢原子数:②④③① |
下列关于钠及其化合物的说法不正确的是( )
| A、Na-K合金常温下呈液态,可做核反应堆的导热剂 |
| B、Na2O和Na2O2其阴阳离子个数比相等,Na2O在空气中加热会变成淡黄色的Na2O2 |
| C、Na2CO3和NaHCO3的水溶液均显碱性,物质的量浓度相等的Na2CO3和NaHCO3溶液,其PH前者大 |
| D、Na2CO3和NaHCO3两固体可用加热法鉴别,Na2CO3和NaHCO3两溶液可滴加Ba(OH)2溶液来鉴别 |
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,下列做法不正确的是( )
| A、研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、铁强化酱油可通过膳食补充人体所需的铁元素 |
| D、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同 |
铝和铍的性质十分相似,下列关于铍性质推断正确的是( )
| A、铍能与强酸或强碱溶液起反应 |
| B、氢氧化铍可溶于水 |
| C、氯化铍溶液显碱性 |
| D、氧化铍的化学式Be2O3 |