题目内容
在硫酸、明矾和硫酸钾组成的混合溶液中,c(Al3+)=0.4mol?L-1、c(SO42-)=0.8mol?L-1、水电离的
c(H+)=10-13 mol?L-1、则c(K+)为( )
c(H+)=10-13 mol?L-1、则c(K+)为( )
| A、0.15 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.3 mol?L-1 |
| D、0.4 mol?L-1 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-).由于含有硫酸、明矾和硫酸钾,溶液显酸性,c(OH-)=10-13 mol?L-1,可以忽略不计.
解答:
解:根据溶液电荷守恒,溶液中存在3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-)关系,由于水电离的c(H+)=10-13 mol?L-1,故溶液中c(OH-)=10-13 mol?L-1,根据水的离子积计算溶液中c(H+)=
=0.1mol?L-1
则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+),
c(K+)═2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L;
故选:C.
| 1×10-14 |
| 1×10-13 |
则有3c(Al3+)+c(K+)+c(H+)=2c(SO42-),所以:c(K+)=2c(SO42-)-3c(Al3+)-c(H+),
c(K+)═2×0.8mol/L-3×0.4mol/L-0.1mol/L=0.3mol/L;
故选:C.
点评:本题考查溶液物质的量浓度的计算,题目难度不大,可利用电荷守恒计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
标准状况下有①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①③②④ |
| B、密度:④①③② |
| C、质量:①④③② |
| D、氢原子数:②④③① |
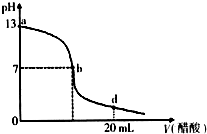 向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )
向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )| A、该NaOH溶液的物质的量浓度为0.1 mol/L |
| B、在b点,c (Na+)=c(CH3COO-) |
| C、该NaOH溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
| D、在d点,溶液中所有离子浓度由大到小的顺序为c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |
下列有关化学用语的说法中不正确的是( )
| A、乙炔的最简式:CH |
| B、乙烯的结构简式:CH2CH2 |
| C、原硅酸的化学式:H4SiO4 |
D、苯的比例模型为: |
铝和铍的性质十分相似,下列关于铍性质推断正确的是( )
| A、铍能与强酸或强碱溶液起反应 |
| B、氢氧化铍可溶于水 |
| C、氯化铍溶液显碱性 |
| D、氧化铍的化学式Be2O3 |
将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
| A、平衡常数减小 |
| B、BaO量不变 |
| C、氧气压强减小 |
| D、BaO2量增加 |
下列比较正确的是( )
| A、密度:K>Na |
| B、离子半径:H->Li+ |
| C、碱性:LiOH>NaOH |
| D、熔沸点:Rb>K |
 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验: