题目内容
下列装置或操作能达到实验目的是( )
A、 量取8.5mL稀硫酸 |
B、 制备FeNaOH溶液 |
C、 防止铁钉生锈 |
D、 用酒精萃取水中的溴 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.50ml量筒精确到1ml;
B.氢氧化亚铁易被空气中的氧气氧化;
C.铁钉做原电池负极;
D.酒精和水互溶.
B.氢氧化亚铁易被空气中的氧气氧化;
C.铁钉做原电池负极;
D.酒精和水互溶.
解答:
解:A.50ml量筒精确到1ml,无法量取8.5mL稀硫酸,故A错误;
B.氢氧化亚铁易被空气中的氧气氧化,应隔绝空气制取,故B正确;
C.铁钉做原电池负极,加快腐蚀,故C错误;
D.酒精和水互溶,不能做萃取剂,故D错误.
故选B.
B.氢氧化亚铁易被空气中的氧气氧化,应隔绝空气制取,故B正确;
C.铁钉做原电池负极,加快腐蚀,故C错误;
D.酒精和水互溶,不能做萃取剂,故D错误.
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及量取液体、物质制备、金属腐蚀和物质分离等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
下列反应是吸热反应又是氧化还原反应的是( )
| A、镁与醋酸 |
| B、氯化铵与氢氧化钡晶体 |
| C、制水煤气的反应 |
| D、盐酸与氢氧化钠 |
标准状况下有①0.112L水;②3.01×1023个氯化氢分子;③13.6g H2S气体;④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①③②④ |
| B、密度:④①③② |
| C、质量:①④③② |
| D、氢原子数:②④③① |
设NA代表阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| B、1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| C、常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,下列做法不正确的是( )
| A、研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、铁强化酱油可通过膳食补充人体所需的铁元素 |
| D、地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同 |
在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A、S(s)+O2(g)=SO2 (g);△H1 S(g)+O2(g)=SO2 (g);△H2 | ||||
| B、2H2(g)+O2 (g)=2H2O(g);△H1 2H2 (g)+O2 (g)=2H2O(l);△H2 | ||||
| C、CO(g)+1/2 O2(g)=CO2(g);△H1 2CO(g)+O2(g)=2CO2(g);△H2 | ||||
D、H2 (g)+Cl2(g)=2HCl(g);△H1
|
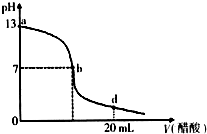 向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )
向20mLNaOH溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如图所示,下列说法不正确的是( )| A、该NaOH溶液的物质的量浓度为0.1 mol/L |
| B、在b点,c (Na+)=c(CH3COO-) |
| C、该NaOH溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 |
| D、在d点,溶液中所有离子浓度由大到小的顺序为c (CH3COO-)>c (Na+)>c (H+)>c (OH-) |
下列有关化学用语的说法中不正确的是( )
| A、乙炔的最简式:CH |
| B、乙烯的结构简式:CH2CH2 |
| C、原硅酸的化学式:H4SiO4 |
D、苯的比例模型为: |