题目内容
17. 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液PH值比开始时明显减小 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
分析 液氨-液氧燃料电池工作时,氨气被氧化,电极方程式为2NH3+6OH--6e-=N2↑+6H2O,正极电极2上是氧气发生得电子的还原反应,碱性环境下电极反应应该是:O2+4e-+2H2O=4OH-,总方程式为4NH3+3O2=2N2+6H2O,以此解答该题.
解答 解:A.1为负极,原电池工作时,阳离子向正极移动,故A错误;
B.总方程式为4NH3+3O2=2N2+6H2O,生成水,溶液体积增大,pH减小,故B正确;
C.在燃料电池的负极上发生燃料氨气失电子的氧化反应,则碱性环境下电极1发生的电极反应为:2NH3+6OH--6e-=N2↑+6H2O,故C正确;
D.由2NH3+6OH--6e-=N2↑+6H2O可知,理论上每消耗0.2 mol NH3,可转移0.6mol电子,但阳极不是纯铜,阳极发生氧化反应,故D错误.
故选BC.
点评 本题考查了原电池原理,为高频考点,注意燃料电池的工作原理和规律:负极上是燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应,题目难度不大.

练习册系列答案
相关题目
7.用48g乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量的乙酸充分反应.下列有关叙述中不正确的是( )
| A. | 生成的水分子中含有18O | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成88g乙酸乙酯 | D. | 不可能生成90g乙酸乙酯 |
8.下列有关物质应用的说法中,不正确的是( )
| A. | 工业上可用Cl2制造漂白粉 | B. | MgO 常用作耐高温材料 | ||
| C. | NaCl用于金属钠的冶炼 | D. | Na2CO3是发酵粉的主要成分之一 |
5.下列卤代烃在KOH醇溶液中加热可以发生消去反应的是( )
①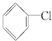 ②
②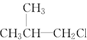 ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤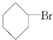 ⑥CH3Cl.
⑥CH3Cl.
①
 ②
②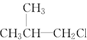 ③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤
③(CH3)3CCH2Cl ④CHCl2CHBr2 ⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | ③⑥ | B. | ①③⑤ | C. | ②④⑤ | D. | ②④ |
12.下列混合溶液中,各离子浓度的大小顺序正确的是( )
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
9.含硫酸的三氧化铬(CrO3)遇酒精(C2H5OH)后,其颜色会从红色变成蓝绿色,利用这个现象可判断汽车司机是否酒后驾车,反应式为:2CrO3+3C2H5OH+3H2SO4→Cr2(SO4)3+3CH3CHO+6H2O,此反应中,硫酸作( )
| A. | 氧化剂 | B. | 酸化剂 | C. | 还原剂 | D. | 催化剂 |
6.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用苯萃取溴水时有机层应从下口放出 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |