题目内容
12.下列混合溶液中,各离子浓度的大小顺序正确的是( )| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
分析 A.二者恰好反应生成氯化铵,铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-);
B.二者恰好反应生成氯化钠和一水合氨,溶液呈碱性,则c(Na+)=c(Cl-)、c(OH-)>c(H+);
C.二者恰好反应生成醋酸钠,醋酸根离子部分水解,则c(Na+)>c(CH3COO-);
D.反应后溶质为醋酸、氯化钠和HCl,溶液呈酸性,则c(H+)>c(OH-).
解答 解:A.10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,反应后溶质为氯化铵,铵根离子部分水解,溶液显示酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-),正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,反应后溶质为NaCl和一水合氨,溶液呈碱性,则c(Na+)=c(Cl-)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)=c(Cl-)>c(OH-)>c(H+),故B正确;
C.10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,反应后溶质为醋酸钠,醋酸根离子部分水解,则c(Na+)>c(CH3COO-),正确的离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D.10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,盐酸过量,反应后溶质为醋酸、氯化钠和HCl,溶液呈酸性,则c(H+)>c(OH-),正确的离子浓度大小为:c(Cl-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

| A. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2+O2=2H2O△H=+285.8 kJ•mol-1 | |
| B. | 由C(石墨)→C(金刚石)△H=+119 kJ•mol-1可知,石墨不及金刚石稳定 | |
| C. | 在稀溶液中:H++OH-=H2O△H=-57.3 kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+(2×283.0 )kJ•mol-1 |
| A. | 单质 | B. | 氧化物 | C. | 碱 | D. | 酸 |
①苯能使溴水萃取分层
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等.
| A. | ④⑤ | B. | ①②③⑤ | C. | ①②③ | D. | ②④⑤ |
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液PH值比开始时明显减小 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A. | X的最高价氧化物能不溶于强碱 | B. | 非金属性:T<R | ||
| C. | 气态氢化物稳定性:T>Z | D. | R与Q的原子核外电子数相差16 |
| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O=Al(OH)3(胶体)+3H+.
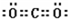 共价键;
共价键;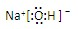 ,离子键,共价键;
,离子键,共价键; ,共价键;
,共价键;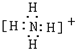 ,共价键.
,共价键.