题目内容
9.含硫酸的三氧化铬(CrO3)遇酒精(C2H5OH)后,其颜色会从红色变成蓝绿色,利用这个现象可判断汽车司机是否酒后驾车,反应式为:2CrO3+3C2H5OH+3H2SO4→Cr2(SO4)3+3CH3CHO+6H2O,此反应中,硫酸作( )| A. | 氧化剂 | B. | 酸化剂 | C. | 还原剂 | D. | 催化剂 |
分析 2CrO3+3C2H5OH+3H2SO4→Cr2(SO4)3+3CH3CHO+6H2O中,Cr元素的化合价由+6价降低为+3价,乙醇中C元素的化合价升高,以此来解答.
解答 解:2CrO3+3C2H5OH+3H2SO4→Cr2(SO4)3+3CH3CHO+6H2O中,只有Cr、C元素的化合价发生变化,则硫酸在反应中作酸化剂,
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
相关题目
19.在1~18号元素中,最外层电子数等于电子层数的元素有( )
| A. | 3种 | B. | 2种 | C. | 1种 | D. | 4种 |
17. 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
 瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示,下列有关说法正确的是( )| A. | 电池工作时,Na+向电极1移动 | |
| B. | 电池工作一段时间后停止,溶液PH值比开始时明显减小 | |
| C. | 电极1发生的电极反应为2NH3+6OH--6e-═N2↑+6H2O | |
| D. | 用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3的同时阳极会得到19.2g纯铜 |
14.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| ① | 将Fe投入硫酸铜溶液中; | 验证Fe的金属性比Cu强. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅④ | B. | ①④ | C. | ②③ | D. | ③④ |
1. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A. | X的最高价氧化物能不溶于强碱 | B. | 非金属性:T<R | ||
| C. | 气态氢化物稳定性:T>Z | D. | R与Q的原子核外电子数相差16 |
1.对于某些离子的检验及结论中一定正确的是( )
| A. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,则一定有SO42- | |
| C. | 用NaOH溶液能鉴别Mg( NO3)2、Cu( NO3)2和NaNO3三种溶液 | |
| D. | 加入硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,一定有Cl- |
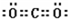 共价键;
共价键;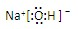 ,离子键,共价键;
,离子键,共价键; ,共价键;
,共价键;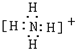 ,共价键.
,共价键.