题目内容
10.由A、B、C、D四种金属按下表中装置进行实验.| 装置 | 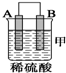 | 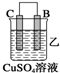 | 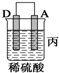 |
| 现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
分析 甲装置中,金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;
丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,
作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C.
解答 解:①该装置中,金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,B作正极,故答案为:B;
②乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,阳离子向正极移动,故答案为:C;
③丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应而作正极,D作负极,故答案为:还原反应;
④通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,故答案为:D>A>B>C.
点评 本题考查原电池的工作原理,根据原电池电极上得失电子和相关实验现象来判断正负极,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
20.Al-H2O2电池可用于海上导航.该电池以碱性海水为电解质溶液,用铝和石墨做电极.下列说法正确的是( )
| A. | Al是该电池的正极 | B. | H2O2在石墨电极上发生氧化反应 | ||
| C. | 石墨电极附近溶液的pH增大 | D. | 海水中的Cl-向正极移动 |
1.下列物质属于醇类的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |
18.下列化学用语正确的是( )
| A. | 葡萄糖的结构简式:C6H12O6 | B. | 中子数为8的碳原子:${\;}_{8}^{14}$C | ||
| C. | Na2O2的电子式: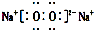 | D. | Cl-离子的结构示意图: |
5.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.5g甲基(-CH3)所含电子数目为NA | |
| B. | 标准状况下,11.2L苯中含有1.5NA 个碳碳双键 | |
| C. | 常温常压下,14 g乙烯和丙烯(C3H6)的混合气体中所含原子总数为3NA | |
| D. | 4.6 g Na与100 mL1.0 mol/L醋酸溶液反应,转移电子数目为0.1NA |
15.下列只含有离子键的化合物是( )
| A. | HI | B. | NaOH | C. | Br2 | D. | NaCl |
2.下列关于苯的说法不正确的是( )
| A. | 分子式是C6H6 | |
| B. | 所有的原子在同一平面上 | |
| C. | 存在碳碳单键与碳碳双键交替出现的结构 | |
| D. | 能和浓硝酸浓硫酸的混合物在一定条件下发生取代反应 |
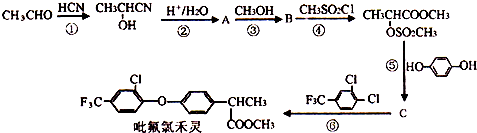
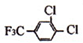 +
+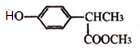 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$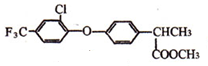 +HCl.
+HCl. .
.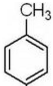 制备高分子化合物
制备高分子化合物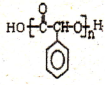 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.