题目内容
13.(1)As的原子结构示意图为 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.(2)Cl2O是HClO(填一种酸的化学式)的酸酐,Cl2O电子式为
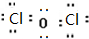 ;
;下列能判断Cl和O两种元素非金属性强弱的是ac(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)请根据周期表中第三周期元素相关知识回答:
氧化性最弱的简单阳离子是Na+;
按原子序数递增的顺序(稀有气体除外),以下说法正确的是b(选填编号).
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水化物碱性减弱,酸性增强.
分析 (1)周期数等于电子层数,主族充数等于最外层电子数;
(2)酸酐与对应酸中Cl元素的化合价相同,Cl2O的结构为Cl-O-Cl,其电子式为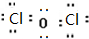 ;
;
a.氧化氯的分子式中O为负价,则非金属性O大于Cl;
b.与金属反应得电子的数目,不能比较非金属性;
c.气态氢化物的稳定性强的为水,则非金属性O大于Cl;
d.O元素不存在最高价氧化物对应水化物;
(3)请根据周期表中第三周期元素相关知识回答:氧化性最弱的简单阳离子是金属最强的原子对应的离子;
a.同一周期,随着原子序数的增大,原子半径逐渐减小,简单离子半径先减小后增大再减小;
b.同一周期元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强;
c.同一周期元素,其单质的熔点先增大后减小;
d.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强;
解答 解:(1)As的原子结构示意图为 ,四个周期,最外层5个电子,所以是第四周期,第ⅤA族,故答案为:第四周期,第ⅤA族;
,四个周期,最外层5个电子,所以是第四周期,第ⅤA族,故答案为:第四周期,第ⅤA族;
(2)酸酐与对应酸中Cl元素的化合价相同,则Cl2O是为HClO的酸酐,Cl2O的结构为Cl-O-Cl,其电子式为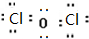 ,
,
a.氧化氯的分子式中O为负价,则非金属性O大于Cl,故正确;
b.与金属反应得电子的数目,不能比较非金属性,故错误;
c.气态氢化物的稳定性强的为水,则非金属性O大于Cl,故正确;
d.O元素不存在最高价氧化物对应水化物,故错误;
故答案为:HClO;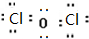 ;ac;
;ac;
(3)请根据周期表中第三周期元素相关知识回答:氧化性最弱的简单阳离子是金属最强的原子对应的离子,所以是钠离子;
a.第三周期中,随着原子序数的递增,原子半径逐渐减小,而离子半径需要根据阴阳离子进行讨论,阳离子只有2个电子层,随着核电荷数在增大,半径逐渐减小,而阴离子有3个电子层,随着核电荷数的增加逐渐减小,但是阴离子半径整体大于阳离子半径,从阳离子到阴离子,半径在增大,故a错误;
b.同一周期中,随着核电荷数的递增,元素的金属性逐渐减弱,非金属性逐渐增强,故b正确;
c.同一周期元素,其单质的熔点先增大后减小,Si的熔点最高,故c错误;
d.元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以其最高价氧化物的水化物碱性减弱、酸性增强,故d错误;
故答案为:Na+;b.
点评 本题考查较综合,涉及同一周期中元素周期律与原子结构的关系、电子式的书写等知识,注重高频考点的考查,题目难度较大,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案用4.0mL 0.001mol/L KMnO4溶液与2.0mL 0.010mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 实验组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2.0mL | 20 | / |
| Ⅱ | 2.0mL | 20 | 少量MnSO4粉末 |
| Ⅲ | 2.0mL | 30 | / |
| Ⅳ | 1.0mL | 20 | 1.0mL蒸馏水 |
(2)本实验可通过观察高锰酸钾溶液完全褪色的时间来比较各组反应的反应速率大小,要观察到预期现象,草酸的物质的量必须满足过量(填“过量”、“恰好完全反应”或“不够反应量”)的条件.
(3)对比实验I和II,可以研究催化剂对化学反应速率的影响.
(4)对比实验I和IV,可以研究H+的浓度(或硫酸溶液的浓度)对化学反应速率的影响,实验IV加人1.0mL蒸馏水的目的是确保溶液总体积相同,仅改变硫酸的浓度,而高锰酸钾浓度和草酸浓度都相同.

实验 记录 | ①Zn质量减少,Cu质量不变; ②外电路电流方向是:由Cu→Zn; ③SO42- 向Cu极移动; ④Zn电极发生氧化反应; ⑤正极反应式:Cu2++2e-═Cu |
| A. | ①②④ | B. | ②③④ | C. | ②④⑤ | D. | ①③⑤ |
| A. | 2412Mg和2612Mg | B. | O2和O3 | C. | NO和NO2 | D. | H2O和H2O2 |
| A. | 碱性:KOH>NaOH | B. | Mg、Al与同浓度盐酸反应,Mg更剧烈 | ||
| C. | 稳定性:HBr>HI | D. | 酸性:H3PO4>HNO3 |
| 选项 | 实验目的 | 实验方案 |
| A | 检验Fe2O3中是否含有FeO | 向少量固体样品中加入适量稀硝酸溶解后,再滴加少量的高锰酸钾溶解 |
| B | 测定NaHCO3和NH4Cl固体混合物中NaHCO3 的质量分数 | 准确称取ag样品和坩埚总质量,加强热后在空 气中冷却至室温,再称量得到总质量为bg |
| C | 探究温度对化学平衡的影响 | 把装有颜色相同的NO2和N2O4混合气体的两支试管(密封)分别浸入冷水和热水中 |
| D | 除去CO2气体中混有的少量HCl气体 | 将混合气体依次通过盛有饱和Na2CO3溶液和浓H2SO4的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-═Cu2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
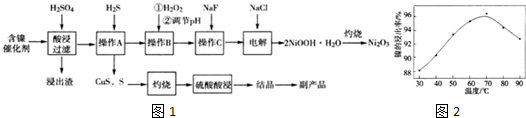
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(1)流程中酸浸后浸出渣包含多种成分.最难溶的强电解质的化学式为BaSO4.
(2)实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图2所示.请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因:温度升高,Ni2+的水解程度增大,浸出渣中Ni(OH)2含量增大,浸出率降低.
(3)操作A的名称为过滤,操作B中需调节溶液的pH,所需调节的pH范围为3.7-7.7,操作C的目的是除去溶液中的Ca2+.
(4)电解步骤中,Cl-首先在阳极被氧化为ClO-,然后C1O-将Ni2+氧化成2NiOOH•H2O沉淀.写出生成沉淀反应的离子方程式:ClO-+2Ni2++4OH-=2NiOOH.H2O+Cl-.若实验最后得到Ni2O3 33,.2g,则电解过程中,电路中转移的电子数至少为2.41×1023 个.
| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |