题目内容
3.原子序数依次增大的A、B、C、D、E五种前20号的主族元素,其中A和C、B和D分别在同一主族,且它们原子的最外层电子数之和为20.已知A的氧化物能引起温室效应,E的单质能与水剧烈反应且同主族中存在金属和非金属元素,下列说法正确的是( )| A. | B的氢化物的沸点比D的氢化物要高,原因是B的非金属性强 | |
| B. | 比较A、C元素形成的常见氧化物,它们的化学键类型相同,晶体类型也相同 | |
| C. | C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性强 | |
| D. | 根据元素周期律,推测E在氧气中燃烧时可能生成E2O2、EO2等物质 |
分析 原子序数依次增大的A、B、C、D、E五种前20号的主族元素,已知A的氧化物能引起温室效应,A为C元素;E的单质能与水剧烈反应且同主族中存在金属和非金属元素,则E为Na或K,其中A和C、B和D分别在同一主族,则C为Si,可知E只能为K,由它们原子的最外层电子数之和为20,设B的最外层电子数为x,则4×2+x×2=20,解得x=6,则B为O,D为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:原子序数依次增大的A、B、C、D、E五种前20号的主族元素,已知A的氧化物能引起温室效应,A为C元素;E的单质能与水剧烈反应且同主族中存在金属和非金属元素,则E为Na或K,其中A和C、B和D分别在同一主族,则C为Si,可知E只能为K,由它们原子的最外层电子数之和为20,设B的最外层电子数为x,则4×2+x×2=20,解得x=6,则B为O,D为S,
A.B的氢化物的沸点比D的氢化物要高,与水中含氢键有关,与O的非金属性强无关,故A错误;
B.二氧化碳、二氧化硅中化学键相同,晶体类型分别为分子晶体、原子晶体,故B错误;
C.非金属性D大于C,则C的最高价氧化物的水化物酸性比D的最高价氧化物的水化物酸性弱,故C错误;
D.根据元素周期律,K的金属性大于Na,则推测E在氧气中燃烧时可能生成E2O2、EO2等物质,故D正确;
故选D.
点评 本题考查原子结构及元素周期律,为高频考点,把握元素在周期表的位置、元素化合物知识推断元素为解答的关键,侧重分析与推断能力的考查,注意原子结构及元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
14.下列物质不属于有机物的是( )
| A. | C2H4 | B. | C12H22O11 | C. | C60 | D. | HCOOH |
18.某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则其化学式中x、m、n的关系不可能是( )
| A. | m:n=2:1 | B. | m=2x | C. | x:m:n=1:2:1 | D. | m=2x+2 |
15.重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
| A. | 氘(2H)原子核内有1个质子 | |
| B. | 1H与2H是不同的核素 | |
| C. | 1H218O与2H216O的相对分子质量相同 | |
| D. | 1H2O与2H2O互为同位素 |
12.汽车尾气中含有CO、NO等有害气体.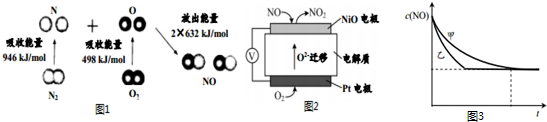
(1)汽车尾气中NO生成过程的能量变化示意图如图1.该条件下,1molN2和1molO2完全反应生成NO,会吸收(填“吸收”或“放出”)180kJ能量.
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是氧化反应(填“氧化”或“还原”).
②外电路中,电子流动方向是从NiO电极流向pt电极(填“NiO”或“pt”).
③pt电极上的电极反应式为O2+4e-=2O2-.
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO?2CO2+N2.已知增大催化剂的比表面积可提高该反应速率.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中.
①请表中数据补充完整:a1.2×10-3;b5.80×10-3.
②能验证温度对化学反应速率规律的是实验Ⅰ和Ⅲ(填实验序号).
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线乙(填“甲”或“乙”).

(1)汽车尾气中NO生成过程的能量变化示意图如图1.该条件下,1molN2和1molO2完全反应生成NO,会吸收(填“吸收”或“放出”)180kJ能量.
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是氧化反应(填“氧化”或“还原”).
②外电路中,电子流动方向是从NiO电极流向pt电极(填“NiO”或“pt”).
③pt电极上的电极反应式为O2+4e-=2O2-.
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO?2CO2+N2.已知增大催化剂的比表面积可提高该反应速率.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中.
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
②能验证温度对化学反应速率规律的是实验Ⅰ和Ⅲ(填实验序号).
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线乙(填“甲”或“乙”).
13.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
①移去生成物②升高温度③增大压强④增大反应物的浓度⑤加入催化剂.
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ②⑤ | D. | ③④ |
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.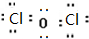 ;
;
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.