题目内容
2.Ni2O3是灰黑色无气味、有光泽的固体,主要用作陶瓷、玻璃、搪瓷的着色颜料,也经常用于制造镍电池.某实验室尝试用工业废弃的NiO催化剂(还含有Fe2O3、CaO、CuO、BaO等杂质)为原料制备Ni2O3,实验工艺流程为如图1:
已知:①有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(1)流程中酸浸后浸出渣包含多种成分.最难溶的强电解质的化学式为BaSO4.
(2)实验人员发现温度不同时,镍的浸出率不同,浸出率与温度的关系如图2所示.请解释当温度高于70℃时,浸出液中Ni2+含量降低的原因:温度升高,Ni2+的水解程度增大,浸出渣中Ni(OH)2含量增大,浸出率降低.
(3)操作A的名称为过滤,操作B中需调节溶液的pH,所需调节的pH范围为3.7-7.7,操作C的目的是除去溶液中的Ca2+.
(4)电解步骤中,Cl-首先在阳极被氧化为ClO-,然后C1O-将Ni2+氧化成2NiOOH•H2O沉淀.写出生成沉淀反应的离子方程式:ClO-+2Ni2++4OH-=2NiOOH.H2O+Cl-.若实验最后得到Ni2O3 33,.2g,则电解过程中,电路中转移的电子数至少为2.41×1023 个.
分析 (1)含镍催化剂中含有Fe2O3、CaO、CuO、BaO等杂质,能和稀硫酸反应生成白色沉淀且最难溶的为硫酸钡;
(2)由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大;
(3)产物中的难容与水的固体CuS、S的分离方法为过滤,加入H2O2,使溶液中的Fe2+氧化为Fe3+,调节pH使得Ni2+沉淀,三价铁不能沉淀,根据表格数据可知,pH范围为3.7-7.7之间,加氟化钠的目的是除去溶液中的钙离子;
(4)Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,33.2gNi2O3为0.2mol,二价镍离子变为+3价镍0.2molNi2O3,转移电子的物质的量为0.4mol,数目为0.4NA,即2.41×1023 .
解答 解(1)含镍催化剂中含有Fe2O3、CaO、CuO、BaO等杂质,能和稀硫酸反应生成白色沉淀且最难溶的为硫酸钡,故答案为:BaSO4;
(2)由于随着温度升高,Ni2+的水解程度增大,从而导致镍的浸出率降低,浸出渣中Ni(OH)2含量增大,故答案为:温度升高,Ni2+的水解程度增大;
(3)产物中的难容与水的固体CuS、S的分离方法为过滤,加入H2O2,使溶液中的Fe2+氧化为Fe3+,调节pH使得Ni2+沉淀,三价铁不能沉淀,根据表格数据可知,pH范围为3.7-7.7之间,加氟化钠的目的是除去溶液中的钙离子;
故答案为:过滤;3.7-7.7;除去溶液中的钙离子;
(4)Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,33.2gNi2O3为0.2mol,二价镍离子变为+3价镍0.2molNi2O3,转移电子的物质的量为0.4mol,数目为0.4NA,即2.41×1023,
故答案为:ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-;2.41×1023.
点评 该题以废旧含镍催化剂生产Ni2O3为载体,重点考查学生对工艺流程试题了解掌握情况,试题综合性强,贴近高考,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案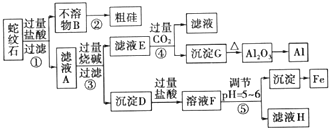
有关氢氧化物沉淀时的pH见表
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+
(2)操作②中涉及的化学方程式为2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)除去MgCl2溶液中的HCl,可以选用的试剂为cd(填字母)
a.NaOH溶液 b.氨水c.MgO d.Mg(0H)2
(4)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$ $\stackrel{冷却结晶}{→}$MgCl2•6H2O$\stackrel{脱水}{→}$MgCl2→Mg
该流程中由MgCl2冶炼Mg的方法是电解
(5)工业上常用碱液除去铝表面的氧化膜,碱洗时常有气泡冒出,原因是2Al+2OH-+2H2O═2AlO2-+3H2↑(用离子方程式表示),为将碱洗液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的b
a.NH3 b.CO2c.NaOH d.HNO3.
| A. | C2H4 | B. | C12H22O11 | C. | C60 | D. | HCOOH |
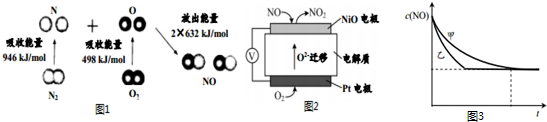
(1)汽车尾气中NO生成过程的能量变化示意图如图1.该条件下,1molN2和1molO2完全反应生成NO,会吸收(填“吸收”或“放出”)180kJ能量.
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图2所示:
①NiO电极上发生的是氧化反应(填“氧化”或“还原”).
②外电路中,电子流动方向是从NiO电极流向pt电极(填“NiO”或“pt”).
③pt电极上的电极反应式为O2+4e-=2O2-.
(2)一种新型催化剂能使NO和CO发生反应:2NO+2CO?2CO2+N2.已知增大催化剂的比表面积可提高该反应速率.为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中.
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
②能验证温度对化学反应速率规律的是实验Ⅰ和Ⅲ(填实验序号).
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图3所示,其中表示实验Ⅱ的是曲线乙(填“甲”或“乙”).
 ,则其在周期表中的位置是第四周期,第ⅤA族.
,则其在周期表中的位置是第四周期,第ⅤA族.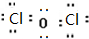 ;
; .
.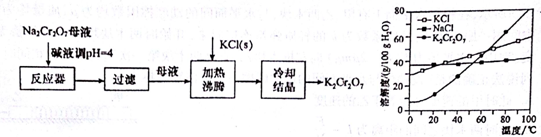
 Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.
Cr(OH)3+3H+,溶液中H+放电,c(H+)下降,平衡向右移动,使Cr3+形成Cr(OH)3沉淀;若电解后的溶液中c(Fe3+)为1.3×10-13mol/L,则溶液中Cr3+浓度为3.0×10-5mol/L.