题目内容
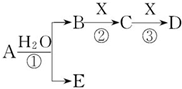 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):(1)若C为当今需要减排的一种热点温室气体,A和E是一种气体氧化物,则①反应的化学反应方程式为
(2)若D为白色胶状难溶物,且与A摩尔质量相等,则A的化学式为
(3)若A为CO,则D的化学式为
考点:无机物的推断
专题:
分析:A、B、C、D、E是短周期元素组成的中学常见的物质,
(1)若C为当今需要减排的一种热点温室气体,则C是CO2,A和E是一种气体氧化物,A能和水反应,和水反应生成一种氧化物,B能和某种物质反应生成CO2,则X是碳酸盐,B是酸,只有NO2能和水反应生成一种酸和氧化物,所以A是NO2、B是HNO3、E是NO,X全部由短周期元素组成,应该为Na2CO3,则D是NaHCO3;
(2)若D为白色胶状难溶物,且是由短周期元素组成的化合物,所以D是Al(OH)3,且与A摩尔质量相等,则A是Na2O2,过氧化钠能和水反应生成NaOH和O2,所以B是NaOH、E是O2,NaOH和AlCl3反应生成NaAlO2,NaAlO2和AlCl3反应生成Al(OH)3;
(3)若A为CO,CO和水蒸气反应生成CO2和H2,CO2能和碱反应生成碳酸盐、碳酸氢盐,所以B是CO2、E是H2,X全部由短周期元素组成,则X是NaOH,C是NaHCO3、D是Na2CO3,再结合题目解答.
(1)若C为当今需要减排的一种热点温室气体,则C是CO2,A和E是一种气体氧化物,A能和水反应,和水反应生成一种氧化物,B能和某种物质反应生成CO2,则X是碳酸盐,B是酸,只有NO2能和水反应生成一种酸和氧化物,所以A是NO2、B是HNO3、E是NO,X全部由短周期元素组成,应该为Na2CO3,则D是NaHCO3;
(2)若D为白色胶状难溶物,且是由短周期元素组成的化合物,所以D是Al(OH)3,且与A摩尔质量相等,则A是Na2O2,过氧化钠能和水反应生成NaOH和O2,所以B是NaOH、E是O2,NaOH和AlCl3反应生成NaAlO2,NaAlO2和AlCl3反应生成Al(OH)3;
(3)若A为CO,CO和水蒸气反应生成CO2和H2,CO2能和碱反应生成碳酸盐、碳酸氢盐,所以B是CO2、E是H2,X全部由短周期元素组成,则X是NaOH,C是NaHCO3、D是Na2CO3,再结合题目解答.
解答:
解:A、B、C、D、E是短周期元素组成的中学常见的物质,
(1)若C为当今需要减排的一种热点温室气体,则C是CO2,A和E是一种气体氧化物,A能和水反应,和水反应生成一种氧化物,B能和某种物质反应生成CO2,则X是碳酸盐,B是酸,只有NO2能和水反应生成一种酸和氧化物,所以A是NO2、B是HNO3、E是NO,X全部由短周期元素组成,应该为Na2CO3,则D是NaHCO3,
通过以上分析知,反应①为二氧化氮和水的反应,方程式为3NO2+H2O=2HNO3+NO,X的化学式为Na2CO3,
故答案为:3NO2+H2O=2HNO3+NO;Na2CO3;
(2)若D为白色胶状难溶物,且是由短周期元素组成的化合物,所以D是Al(OH)3,且与A摩尔质量相等,则A是Na2O2,过氧化钠能和水反应生成NaOH和O2,所以B是NaOH、E是O2,NaOH和AlCl3反应生成NaAlO2,NaAlO2和AlCl3反应生成Al(OH)3,所以A的化学式为Na2CO3,反应③的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Na2CO3;Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)若A为CO,CO和水蒸气反应生成CO2和H2,CO2能和碱反应生成碳酸盐、碳酸氢盐,所以B是CO2、E是H2,X全部由短周期元素组成,则X是NaOH,C是NaHCO3、D是Na2CO3,所以D的化学式为Na2CO3,
该反应方程式为CO(g)+H2O(g)?CO2(g)+H2(g),第一次平衡时CO的转化率为20%,则转化的物质的量=3mol×20%=0.6mol,
CO(g)+H2O(g)?CO2(g)+H2(g)
0.6mol 0.6mol 0.6mol 0.6mol
2.4mol 0.15mol 0.6mol 0.6mol
平衡浓度分别为c(CO)=
=1.2mol/L、c(H2O)=
=0.075mol/L、c(CO2)=
c(H2)=
=0.3mol/L,平衡常数K=
=1,
再次达到平衡时,设CO的转化率为x
CO(g)+H2O(g)?CO2(g)+H2(g)
3xmol 3xmol 3xmol 3xmol
3(1-x)mol(4.5-3x)mol 3xmol 3xmol,
因为这几种物质的计量数都是1,所以其平衡浓度计量数次方之比与其物质的量次方之比相同,所以平衡常数K=
=1,x=60%,
故答案为:Na2CO3;60%.
(1)若C为当今需要减排的一种热点温室气体,则C是CO2,A和E是一种气体氧化物,A能和水反应,和水反应生成一种氧化物,B能和某种物质反应生成CO2,则X是碳酸盐,B是酸,只有NO2能和水反应生成一种酸和氧化物,所以A是NO2、B是HNO3、E是NO,X全部由短周期元素组成,应该为Na2CO3,则D是NaHCO3,
通过以上分析知,反应①为二氧化氮和水的反应,方程式为3NO2+H2O=2HNO3+NO,X的化学式为Na2CO3,
故答案为:3NO2+H2O=2HNO3+NO;Na2CO3;
(2)若D为白色胶状难溶物,且是由短周期元素组成的化合物,所以D是Al(OH)3,且与A摩尔质量相等,则A是Na2O2,过氧化钠能和水反应生成NaOH和O2,所以B是NaOH、E是O2,NaOH和AlCl3反应生成NaAlO2,NaAlO2和AlCl3反应生成Al(OH)3,所以A的化学式为Na2CO3,反应③的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Na2CO3;Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)若A为CO,CO和水蒸气反应生成CO2和H2,CO2能和碱反应生成碳酸盐、碳酸氢盐,所以B是CO2、E是H2,X全部由短周期元素组成,则X是NaOH,C是NaHCO3、D是Na2CO3,所以D的化学式为Na2CO3,
该反应方程式为CO(g)+H2O(g)?CO2(g)+H2(g),第一次平衡时CO的转化率为20%,则转化的物质的量=3mol×20%=0.6mol,
CO(g)+H2O(g)?CO2(g)+H2(g)
0.6mol 0.6mol 0.6mol 0.6mol
2.4mol 0.15mol 0.6mol 0.6mol
平衡浓度分别为c(CO)=
| 2.4mol |
| 2L |
| 0.15mol |
| 2L |
c(H2)=
| 0.6mol |
| 2L |
| 0.3×0.3 |
| 1.2×0.075 |
再次达到平衡时,设CO的转化率为x
CO(g)+H2O(g)?CO2(g)+H2(g)
3xmol 3xmol 3xmol 3xmol
3(1-x)mol(4.5-3x)mol 3xmol 3xmol,
因为这几种物质的计量数都是1,所以其平衡浓度计量数次方之比与其物质的量次方之比相同,所以平衡常数K=
| 3x×3x |
| 3(1-x).(4.5-3x) |
故答案为:Na2CO3;60%.
点评:本题考查无机推断,根据物质之间的转化结合“全部由短周期元素组成”来推断物质,侧重考查学生分析问题、知识运用能力,难点是化学平衡的计算,温度不变其平衡常数不变,根据平衡常数解答即可,题目难度中等.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
下列关于溶液和胶体的叙述,正确的是( )
| A、直径介于1nm~100nm之间的微粒称为胶体 |
| B、电泳现象可证明胶体带电 |
| C、可用丁达尔效应来区分溶液和胶体 |
| D、刚含1molFeCl3的溶液可制得6.02×1023个Fe(OH)3胶体粒子 |
最近俄罗斯科学家用铪和钨两种核素精确测定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据182 72 Hf(铪-182)和182 74 W(钨-182)两种核素的含量比例得出的.下列有关铪-182和钨-182的关系说法正确的是( )
| A、互为同位素 |
| B、都属于镧系元素 |
| C、中子数相等 |
| D、原子质量几乎相同 |
一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:A(g)+3B(g)?2C(g)经2分钟反应达到平衡,此时生成0.2mol C.下列说法正确的是( )
| A、反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L?min) |
| B、反应开始至2分钟时,A的转化率为10% |
| C、若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0 |
D、若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图 |