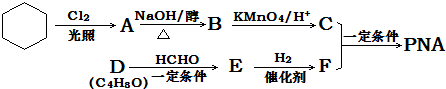
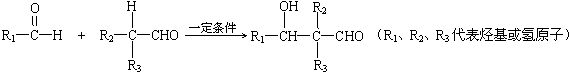
题目内容
在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-92.3KJ/mol
0~4min时,容器内气体压强为101KPa,反应过程中,SO2、O2、SO3的物质的量n (mol)的变化如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式是K= .
(2)在3---4min时间段,反应处于 状态.
(3)计算:0~3min时间内,(容器体积设为1升)用SO2表示该反应的平均反应速率是 mol/(L?min),7min时,SO2的转化率为 .
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是 ;平衡向 方向移动.
| 催化剂 |
| △ |
0~4min时,容器内气体压强为101KPa,反应过程中,SO2、O2、SO3的物质的量n (mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=
(2)在3---4min时间段,反应处于
(3)计算:0~3min时间内,(容器体积设为1升)用SO2表示该反应的平均反应速率是
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是
考点:化学平衡的计算,化学平衡的影响因素
专题:化学平衡专题
分析:(1)平衡常数=
;
(2)依据物质物质的量不变判断反应达到的平衡;
(3)反应速率=
计算得到,转化率=
×100%;
(4)依据第5min时物质的物质的量变化分析二氧化硫和氧气物质的量减小,三氧化硫物质的量增加,平衡正向进行.
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
(2)依据物质物质的量不变判断反应达到的平衡;
(3)反应速率=
| △c |
| △t |
| 消耗量 |
| 起始量 |
(4)依据第5min时物质的物质的量变化分析二氧化硫和氧气物质的量减小,三氧化硫物质的量增加,平衡正向进行.
解答:
解:(1)2SO2(g)+O2(g)
2SO3(g)△H=-92.3KJ/mol,平衡常数K=
;
故答案为:
;
(2)图表数据分析可知在3~4min和7~9min时,二氧化硫、氧气和三氧化硫物质的量不变说明反应达到平衡,故答案为:平衡;
(3)0~3min时间内,(容器体积设为1升)用SO2表示该反应的平均反应速率=
=0.08mol/(L?min);7min时,SO2的转化率=
×100%=30%;
故答案为:0.08;30%;
(4)第5min时物质的物质的量变化分析二氧化硫和氧气物质的量减小,三氧化硫物质的量增加,平衡正向进行,依据平衡移动原理分析可知增大压强平衡正向进行;符合物质的量变化;
故答案为:增大压强;正.
| 催化剂 |
| △ |
| c2(SO3) |
| c2(SO2×c(O2)) |
故答案为:
| c2(SO3) |
| c2(SO2×c(O2)) |
(2)图表数据分析可知在3~4min和7~9min时,二氧化硫、氧气和三氧化硫物质的量不变说明反应达到平衡,故答案为:平衡;
(3)0~3min时间内,(容器体积设为1升)用SO2表示该反应的平均反应速率=
| ||
| 3min |
| 2mol-1.4mol |
| 2mol |
故答案为:0.08;30%;
(4)第5min时物质的物质的量变化分析二氧化硫和氧气物质的量减小,三氧化硫物质的量增加,平衡正向进行,依据平衡移动原理分析可知增大压强平衡正向进行;符合物质的量变化;
故答案为:增大压强;正.
点评:本本题考查了化学平衡计算、平衡常数概念应用,主要是费用速率、转化率计算分析,影响反应速率和化学平衡的因素,题目难度中等.

练习册系列答案
相关题目
下列化学反应中,属于氧化还原反应的是( )
| A、Al(OH)3+3HCl═AlCl3+3H2O |
| B、NH4HCO3═NH3↑+H2O+CO2↑ |
| C、H2O+CaO═Ca(OH)2 |
| D、3Cl2+2NH3=N2+6HCl |
1998年7月8日,全国科学技术名称审定委员会公布了101-109号元素的中文定名.而早在1996年2月,德国达姆施塔特重离子研究所就合成出当时最重的人造元素,它是由
Zn撞入一个
Pb的原子核,并立即释放一个中子而产生的一种新元素的原子.该元素的原子序数是( )
70 30 |
208 82 |
| A、111 | B、112 |
| C、113 | D、114 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表
已知表中t1>t2,下列说法不正确的是( )
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时间容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升至800℃时,若上述反应平衡常数为0.64,则正反应为吸热反应 |
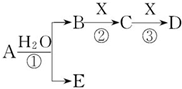 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):