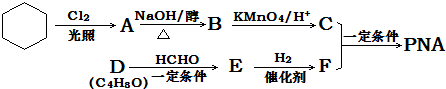
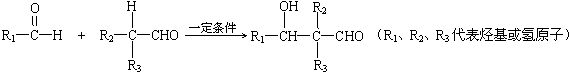
题目内容
A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍.C和D的最外层电子数之和为11.请回答下列问题:
(1)以上元索中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式) ,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示) .
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 .
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式 .
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y的化学式为 ,向Y中加足量稀硫酸后,再加高锰酸钾溶液,可使酸性高锰酸钾溶液褪色:写出使酸性高锰酸钾溶液褪色的离子方程式 .
(1)以上元索中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C、D、F三种元素的原子序数之和为28,则C的原子序数=28-8-13=7,故C为N;D与L分别为同主族,则L为S;B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,L为S,则I为Cl,据此解答.
解答:
解:A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,它们的原子序数依次增大,则A为氢元素;A与E同一主族,E原子序数比A至少大4,可推知E为Na;B、C、D为同一周期,应处于第二周期,E、F、G、H都处于第三周期,令F的最外层电子数为x,其质子数为10+x,则D原子最外层电子数为2x,质子数为2+2x,由于F的质子数比D多5,则有:10+x-(2-2x)=5,解得x=3,故F为Al、D为O,C、D、F三种元素的原子序数之和为28,则C的原子序数=28-8-13=7,故C为N;D与L分别为同主族,则L为S;B与G同主族,结合原子序数可知,处于ⅣA族,故B为C、G为Si,L为S,则I为Cl,
(1)非金属最弱的是硅,所以气态氢化物稳定性最弱的是硅化氢,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Na+>Al3+,故答案为:SiH4;S2-;S2->Na+>Al3+;
(2)氯和硫两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,的分子式为S2Cl2,电子式为: ,故答案为:
,故答案为: ;
;
(3)固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S+2Na++4OH-,
故答案为:Na2O2+2H2O+S2-=S↓+2Na++4OH-;
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y是草酸铵,化学式为:(NH4)2C2O4,加足量稀硫酸后,再加高锰酸锰反应生成的离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:(NH4)2C2O4;2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
(1)非金属最弱的是硅,所以气态氢化物稳定性最弱的是硅化氢,电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Na+>Al3+,故答案为:SiH4;S2-;S2->Na+>Al3+;
(2)氯和硫两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,的分子式为S2Cl2,电子式为:
 ,故答案为:
,故答案为: ;
;(3)固体化合物Na2O2与化合物Na2S的水溶液按物质的量之比1:1反应生成单质S,同时生成NaOH,该反应的离子方程式为Na2O2+2H2O+S2-=S+2Na++4OH-,
故答案为:Na2O2+2H2O+S2-=S↓+2Na++4OH-;
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y是草酸铵,化学式为:(NH4)2C2O4,加足量稀硫酸后,再加高锰酸锰反应生成的离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,
故答案为:(NH4)2C2O4;2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
点评:本题结构性质位置关系综合应用,涉及元素周期律、比较离子半径、电子式、氧化还原方程式书写等,难度中等,推断元素是解题的关键.

练习册系列答案
相关题目
氢气与碘蒸气按1:1体积比混和,使其在一定条件下反应,达到平衡时,碘化氢气体体积占反混合气体体积的50%,则反应混合气体中氢气所占的体积百分比是( )
| A、50% | B、33.3% |
| C、25% | D、20% |
铁镍蓄电池又称爱迪生电池,其充、放电按下式进行:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
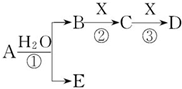 A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去):
A、B、C、D、E是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分产物和反应条件略去): 前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题: