题目内容
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol?L-1,c(SO42-)=0.8mol?L-1,则c(K+)为 .
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据电荷守恒,3(Al3+)+c(K+)+c(H+)=2(SO42-),据此计算.
解答:
解:混合溶液pH=1,则c(H+)=0.1mol/L,根据电荷守恒,3(Al3+)+c(K+)+c(H+)=2(SO42-),即3×0.4mol/L+c(K+)+0.1mol/L=2×0.8mol/L,解得c(K+)=0.3mol/L,
故答案为:0.3mol/L.
故答案为:0.3mol/L.
点评:本题考查物质的量浓度有关计算,难度不大,电解质混合溶液中离子浓度计算常用电荷守恒解答.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、水是极弱的电解质,它能微弱电离生成H+,所以严格地说纯水呈微酸性 |
| B、纯水中c(OH-)×c(H+)=Kw,Kw是一常数,不随任何条件改变而改变 |
| C、25℃纯水中c(OH-)×c(H+)=10-14,稀酸和稀碱中Kw=c(OH-)×c(H+)≠10-14 |
| D、H2O?H++OH-是吸热过程,温度升高,平衡向电离方向移动,Kw随之增大 |
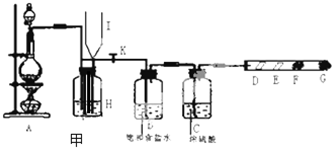
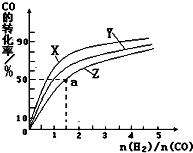 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.