题目内容
某同学设计的制取氯气和验证氯气部分化学性质的实验装置如图甲所示:
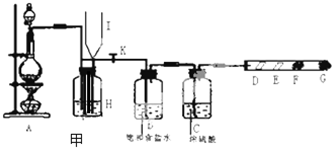
其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸,F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球.回答下列问题:
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的化学方程式:
(2)B处饱和食盐水是为了除去 .
(3)实验中可观察到颜色的变化:D处 ,F处 ,G处棉球的作用是 ,G处反应的化学方程式 .
(4)当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体.则甲装置的作用为 .

其中D处放有干燥的紫色石蕊试纸,E处放有湿润的紫色石蕊试纸,F、G处依次放有喷上少量淀粉KI溶液、浓NaOH溶液的棉球.回答下列问题:
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,请写出A处反应的化学方程式:
(2)B处饱和食盐水是为了除去
(3)实验中可观察到颜色的变化:D处
(4)当F处棉球变色,立即关闭活塞K,可看到I瓶中液面上升,H瓶中充满黄绿色气体.则甲装置的作用为
考点:氯气的实验室制法,氯气的化学性质
专题:卤族元素
分析:(1)根据浓盐酸、二氧化锰的性质及反应条件写出相应的化学反应方程式;
(2)根据浓盐酸易挥发的性质判断氯气中混有杂质的并除去;
(3)氯气不具有漂白性,具有强的氧化性能够氧化碘离子生成单质碘,单质碘遇到淀粉变蓝;
(4)根据装置特点分析.
(2)根据浓盐酸易挥发的性质判断氯气中混有杂质的并除去;
(3)氯气不具有漂白性,具有强的氧化性能够氧化碘离子生成单质碘,单质碘遇到淀粉变蓝;
(4)根据装置特点分析.
解答:
解:(1)浓盐酸具有还原性,二氧化锰有氧化性,在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以制取的氯气中有氯化氢气体,氯化氢极易溶于水,氯气也能溶于水,饱和食盐水中有氯离子,抑制氯气的溶解,且吸收氯化氢气体,
故答案为:氯气中混有氯化氢气体;
(3)氯气不具有漂白性,所以干燥的紫色石蕊试纸不变色;氯气与碘化钾反应生成碘,碘与淀粉变蓝;氯气有毒不能直接排放的空气中,用G吸收氢氧化钠溶液吸收过量的氯气,反应的方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:干燥的紫色石蕊试纸不变色;溶液变蓝;尾气处理,吸收过量的氯气;Cl2+2NaOH═NaCl+NaClO+H2O;
(4)关闭活塞K,生成的氯气进入甲装置,导致H瓶中的压强大于大气压,为平衡压强,导致I瓶中液面上升,H瓶中充满黄绿色气体.所以甲装置的作用是储存多余的氯气,
故答案为:储存多余的氯气.
| ||
故答案为:4HCl(浓)+MnO2
| ||
(2)浓盐酸具有挥发性,所以制取的氯气中有氯化氢气体,氯化氢极易溶于水,氯气也能溶于水,饱和食盐水中有氯离子,抑制氯气的溶解,且吸收氯化氢气体,
故答案为:氯气中混有氯化氢气体;
(3)氯气不具有漂白性,所以干燥的紫色石蕊试纸不变色;氯气与碘化钾反应生成碘,碘与淀粉变蓝;氯气有毒不能直接排放的空气中,用G吸收氢氧化钠溶液吸收过量的氯气,反应的方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:干燥的紫色石蕊试纸不变色;溶液变蓝;尾气处理,吸收过量的氯气;Cl2+2NaOH═NaCl+NaClO+H2O;
(4)关闭活塞K,生成的氯气进入甲装置,导致H瓶中的压强大于大气压,为平衡压强,导致I瓶中液面上升,H瓶中充满黄绿色气体.所以甲装置的作用是储存多余的氯气,
故答案为:储存多余的氯气.
点评:本题考查了氯气的实验室制法及化学性质等知识点,难度不大,熟悉氯气的制备原理和氯气的性质是解题关键,注意次氯酸的漂白性是重要考点.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目