题目内容
下列说法中正确的是( )
| A、水是极弱的电解质,它能微弱电离生成H+,所以严格地说纯水呈微酸性 |
| B、纯水中c(OH-)×c(H+)=Kw,Kw是一常数,不随任何条件改变而改变 |
| C、25℃纯水中c(OH-)×c(H+)=10-14,稀酸和稀碱中Kw=c(OH-)×c(H+)≠10-14 |
| D、H2O?H++OH-是吸热过程,温度升高,平衡向电离方向移动,Kw随之增大 |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:A.水是极弱的电解质,纯水呈中性;
B.Kw是一常数,随温度的改变而改变;
C.纯水中c(OH-)×c(H+)=10-14=Kw,Kw是一常数,故稀酸和稀碱中Kw=c(OH-)×c(H+)=10-14;
D.水的电离是吸热过程,温度升高,平衡向电离方向移动,氢离子和氢氧根离子浓度增大,故Kw随之增大.
B.Kw是一常数,随温度的改变而改变;
C.纯水中c(OH-)×c(H+)=10-14=Kw,Kw是一常数,故稀酸和稀碱中Kw=c(OH-)×c(H+)=10-14;
D.水的电离是吸热过程,温度升高,平衡向电离方向移动,氢离子和氢氧根离子浓度增大,故Kw随之增大.
解答:
解:A.水是极弱的电解质,它能微弱电离生成等量的氢离子和氢氧根离子,故纯水呈中性,故A错误;
B.纯水中c(OH-)×c(H+)=Kw,Kw是一常数,随温度的改变而改变,故B错误;
C.纯水中c(OH-)×c(H+)=10-14=Kw,Kw是一常数,故稀酸和稀碱中Kw=c(OH-)×c(H+)=10-14,故C错误;
D.水的电离是吸热过程,温度升高,平衡向电离方向移动,氢离子和氢氧根离子浓度增大,故Kw随之增大,故D正确;
故选D.
B.纯水中c(OH-)×c(H+)=Kw,Kw是一常数,随温度的改变而改变,故B错误;
C.纯水中c(OH-)×c(H+)=10-14=Kw,Kw是一常数,故稀酸和稀碱中Kw=c(OH-)×c(H+)=10-14,故C错误;
D.水的电离是吸热过程,温度升高,平衡向电离方向移动,氢离子和氢氧根离子浓度增大,故Kw随之增大,故D正确;
故选D.
点评:本题考查水的电离及影响因素、离子积常数等知识,难度不大.要注意离子积常数只与温度有关.

练习册系列答案
相关题目
有X、Y、Z三种金属,能发生以下置换反应:则X、Y、Z三种金属的活动性由强到弱的顺序可排列为( )
①X+H2SO4=XSO4+H2↑ ②Y+HCl→不能反应 ③Z+XSO4=ZSO4+X.
①X+H2SO4=XSO4+H2↑ ②Y+HCl→不能反应 ③Z+XSO4=ZSO4+X.
| A、X、Y、Z |
| B、X、Z、Y |
| C、Y、Z、X |
| D、Z、X、Y |
下列不属于硅酸盐产品的是( )
| A、水泥 | B、砖瓦 | C、陶瓷 | D、硫酸 |
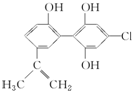 禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )
禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )| A、1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH |
| B、1 mol X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、X遇FeCl3溶液显色,可看作酚类物质 |
| D、兴奋剂X所有碳原子有可能共平面 |
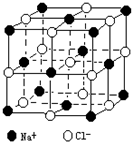 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为: