题目内容
 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
请完成并配平上述化学方程式.
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中有利于增大该反应的反应速率的是
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
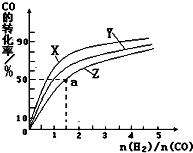
(3)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
考点:氧化还原反应方程式的配平,热化学方程式,化学平衡常数的含义,化学反应速率的影响因素
专题:基本概念与基本理论
分析:(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合化合价升降总数相等以及质量守恒定律配平;
(2)①根据平衡移动原理进行判断,温度升高,反应速率加快,使用催化剂,反应速率加快;
②根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳的热化学方程式;
(3)①合成甲醇的反应是放热反应,温度升高,转化率降低;
②根据平衡常数表达式和一氧化碳的转化率求算.
(2)①根据平衡移动原理进行判断,温度升高,反应速率加快,使用催化剂,反应速率加快;
②根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳的热化学方程式;
(3)①合成甲醇的反应是放热反应,温度升高,转化率降低;
②根据平衡常数表达式和一氧化碳的转化率求算.
解答:
解:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3;2;8H2SO4;3;2;2;8;
(2)①A、随时将CH3OH与反应混合物分离,CH3OH的浓度减小,反应速率降低,故A错误;
B、温度降低,反应速率变小,故B错误;
C、压强增大,反应速率加快,故C正确;
D、使用催化剂,反应速率加快,故D正确;
故答案为:CD;
②已知:
CO(g)+
O2(g)=CO2(g)△H2=-283kJ?mol-1 ①;
H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1②;
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1③;
根据盖斯定律:①+②×2-③得:CH3OH(g)+3/2O2(g)?CO2(g)+2H2O(g)△H=-651kJ?mol-1,
故答案为:CH3OH(g)+
O2(g)?CO2(g)+2H2O(g)△H=-651kJ?mol-1;
(3)①根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案是:270℃;
②该反应的平衡常数K=
,
a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol
剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
a点各组分的浓度是:c(CH3OH)=
=0.5mol/L,c(CO)=
=0.5mol/L,c(H2)=
=0.5mol/L,
带人表达式得:K=
=4L2?mol-2,
故答案是:4L2?mol-2.
故答案为:3;2;8H2SO4;3;2;2;8;
(2)①A、随时将CH3OH与反应混合物分离,CH3OH的浓度减小,反应速率降低,故A错误;
B、温度降低,反应速率变小,故B错误;
C、压强增大,反应速率加快,故C正确;
D、使用催化剂,反应速率加快,故D正确;
故答案为:CD;
②已知:
CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1③;
根据盖斯定律:①+②×2-③得:CH3OH(g)+3/2O2(g)?CO2(g)+2H2O(g)△H=-651kJ?mol-1,
故答案为:CH3OH(g)+
| 3 |
| 2 |
(3)①根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案是:270℃;
②该反应的平衡常数K=
| c(CH3OH) |
| c(CO)?c2(H2) |
a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol
剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,
a点各组分的浓度是:c(CH3OH)=
| 1mol |
| 2L |
| 1mol |
| 2L |
| 1mol |
| 2L |
带人表达式得:K=
| 0.5 |
| 0.5×0.52 |
故答案是:4L2?mol-2.
点评:本题考查了影响反应速率的因素及反应平衡常数的计算、热化学方程式的书写等知识,注意盖斯定律的应用,题目属于综合知识点的考查,侧重于考查学生对所学知识的综合应用能力,难度中等.

练习册系列答案
相关题目