题目内容
4.完成以下实验:①用图1所示的装置制取溴乙烷;②进行溴乙烷的性质实验.在试管I中依次加入2mL 蒸馏水、4mL浓硫酸、2mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.试回答下列问题: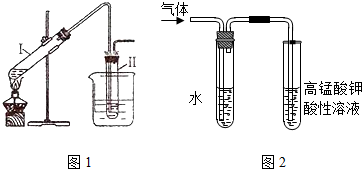
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式HBr+C2H5OH$\stackrel{△}{→}$C2H5Br+H2O
(2)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,图1中采取的措施有试管Ⅱ塞上带有导管的塞子并在其中加水、把试管Ⅱ放入盛有冷水的烧杯中
(3)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过图2所示的装置.用如图2装置进行实验的目的是验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);图中右边试管中的现象是高锰酸钾溶液的紫红色褪去;水的作用是除去气体中混有的少量乙醇等杂质.
分析 ((1)氢溴酸与乙醇在加热时,发生取代反应生成溴乙烷和水;
(2)为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,需要密封、降低温度、冷凝回流等;
(3)溴乙烷与NaOH乙醇溶液共热的性质实验时,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能使高锰酸钾褪色,则利用水除去乙醇后,再检验乙烯.
解答 解:(1)氢溴酸与乙醇在加热时,发生取代反应生成溴乙烷和水,反应为HBr+C2H5OH$\stackrel{△}{→}$C2H5Br+H2O,
故答案为:HBr+C2H5OH$\stackrel{△}{→}$C2H5Br+H2O;
(2)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,图1中采取的措施有试管Ⅱ塞上带有导管的塞子并在其中加水、把试管Ⅱ放入盛有冷水的烧杯中、使用长导管等,
故答案为:试管Ⅱ塞上带有导管的塞子并在其中加水;把试管Ⅱ放入盛有冷水的烧杯中;
(3)溴乙烷与NaOH乙醇溶液共热的性质实验时,发生消去反应生成乙烯,乙醇易挥发,乙醇、乙烯均能使高锰酸钾褪色,则用如图2装置进行实验的目的是验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);图中右边试管中的现象是高锰酸钾溶液的紫红色褪去,水的作用是除去气体中混有的少量乙醇等杂质,
故答案为:验证生成的气体是乙烯(或验证溴乙烷与NaOH发生消去反应的产物);高锰酸钾溶液的紫红色褪去;除去气体中混有的少量乙醇等杂质.
点评 本题考查物质的性质实验及制备实验,为高频考点,把握有机物的性质、实验装置的作用、实验技能为解答的关键,注意检验乙烯要排除乙醇的干扰,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
15.在10L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s),所得实验数据如下表,下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(A) | n(B) | n(C) | ||
| ① | 700 | 4.0 | 1.0 | 1.80 |
| ② | 800 | 1.0 | 4.0 | 1.60 |
| ③ | 800 | 2.0 | 2.0 | a |
| ④ | 900 | 1.0 | 1.0 | b |
| A. | 实验①中,若10min达到平衡,则v(D)=9.0×10-2mol/(L•min) | |
| B. | 实验②中,该反应的平衡常数K=3.2 | |
| C. | 实验③中,达到平衡时A的转化率为60% | |
| D. | 实验④中,达到平衡时,b<1.0 |
12.下列说法正确的是( )
| A. | 分子晶体在水中溶解时,只破坏分子间作用力 | |
| B. | 原子晶体中的各相邻原子都以非极性键相结合 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 含有金属阳离子的晶体不一定是离子晶体 |
19. Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
(1)Mn元素基态原子的电子排布式为[Ar]3d54s2,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.其原因是由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少.
(2)氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.则氯化铁的晶体类型为分子晶体.
(3)金属铁的晶体在不同的温度下有两种堆积方式,如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(4)下列分子或离子中,能提供孤电对与Cu2+形成配位键的是D.(填字母,下同)
①H2O ②NH3 ③F- ④CN-
A.仅①②B.仅①②③C.仅①②④D.①②③④
(5)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液.下列叙述正确的是B.
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.[Cu(NH3)4]2+的空间构型为平面正方形.
 Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:
Mn、Fe均为第四周期过渡元素,部分电离能数据如表所示,请回答下列问题:| 元素 | Mn | Fe | |
| 电离能(kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(2)氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.则氯化铁的晶体类型为分子晶体.
(3)金属铁的晶体在不同的温度下有两种堆积方式,如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2.
(4)下列分子或离子中,能提供孤电对与Cu2+形成配位键的是D.(填字母,下同)
①H2O ②NH3 ③F- ④CN-
A.仅①②B.仅①②③C.仅①②④D.①②③④
(5)向盛有硫酸铜溶液的试管中加入氨水,首先形成难溶物,继续加入氨水,难溶物溶解并得到深蓝色的透明溶液.下列叙述正确的是B.
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后生成深蓝色的[Cu(NH3)4]2+
C.若硫酸铜溶液中混有少量硫酸,则可用氨水除去硫酸铜溶液中的硫酸
D.[Cu(NH3)4]2+的空间构型为平面正方形.
9.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 28gFe与0.5 molCl2充分反应转移电子数为1.5NA | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA | |
| D. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA |
 .
. .
.



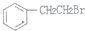 制备
制备 的合成路线.
的合成路线.