题目内容
13.设NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 28gFe与0.5 molCl2充分反应转移电子数为1.5NA | |
| B. | 常温常压下,19 g D3O+含有10 NA个电子 | |
| C. | 室温时,0.1 mol/L Na2CO3溶液中所含Na+数为0.2NA | |
| D. | 25℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.01 NA |
分析 A、28g铁的物质的量为0.5mol,和0.5mol氯气反应时,铁过量,根据氯气反应后变为-1价来分析;
B、求出D3O+的物质的量,然后根据1molD3O+中含10mol电子来分析;
C、溶液体积不明确;
D、pH=12的氢氧化钡溶液中,氢氧根的浓度为0.01mol/L.
解答 解:A、28g铁的物质的量为0.5mol,和0.5mol氯气反应时,铁过量,由于氯气反应后变为-1价,故0.5mol氯气完全反应转移NA个电子,故A错误;
B、19gD3O+的物质的量为n=$\frac{19g}{22g/mol}$<1mol,而1molD3O+中含10mol电子,故19gD3O+中含有的电子数小于10NA个,故B错误;
C、溶液体积不明确,故溶液中的钠离子的个数无法计算,故C错误;
D、pH=12的氢氧化钡溶液中,氢氧根的浓度为0.01mol/L,故1L溶液中含有的氢氧根的物质的量为0.01mol,个数为0.01NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是( )
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
8.离子化合物是离子通过离子键结合成的化合物.下列物质属于离子化合物的是( )
| A. | H2O | B. | HCl | C. | NH4Cl | D. | CO2 |
18.银氨溶液可用于检测CO气体,实验室研究的装置如图:
(1)甲酸(HCOOH)遇浓硫酸分解生成CO和H2O,该反应体现浓硫酸的脱水性性.
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
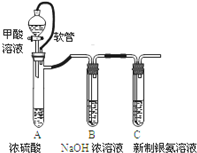 | 已知:①银氨溶液的化学式为: Ag(NH3)2OH ②反应结束后试管C底部有黑色 沉淀生成, ③分离出上层清液和底部黑色 固体备用. |
(2)装置A中软管的作用是恒压,使甲酸溶液能顺利滴下.
(3)为验证上层清液中产物的成分,进行如下实验:
a.测得上层清液pH为10.
b.向上层清液中滴加几滴Ba(OH)2溶液,发现有白色浑浊出现,同时产生能使湿润红色石蕊试纸变蓝的气体.
c.取新制的银氨溶液滴加几滴Ba(OH)2溶液,无明显现象.
①实验c的目的是对比试验,排除银氨溶液对产物检验的干扰.
②根据上述实验现象判断,上层清液中产物成分为(NH4)2CO3(填化学式).
(4)设计实验证明黑色固体的成分是Ag:可供选择的试剂有:浓硫酸、浓硝酸、NaOH溶液、NaCl溶液.
取少量上述黑色固体,用蒸馏水洗净,滴加浓硝酸,固体全部溶解并有少量红棕色气体产生,继续滴加NaCl溶液,能产生白色沉淀,说明黑色固体是Ag单质.(补充必要的实验内容及实验现象)
(5)从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2.
①写出生成AgCl沉淀的离子反应[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O.
②若该反应中消耗3.3g羟氨,理论上可得银的质量为10.8g.
5.合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是( )
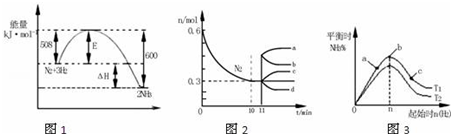

| A. | 由图1可知2NH3(g)?N2(g)+3H2(g)△H=-92kJ•mol-1 | |
| B. | 图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | |
| C. | 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | |
| D. | 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
2.一种香豆素的衍生物结构如图所示,关于该有机物说法正确的是( )


| A. | 该有机物分子式为 C10H10O4 | |
| B. | 1mol该有机物与 H2发生加成时最多消耗H2 5 mol | |
| C. | 1mol该有机物与足量溴水反应时最多消耗Br23 mol | |
| D. | 1mol该有机物与 NaOH 溶液反应是最多消耗NaOH 3 mol |
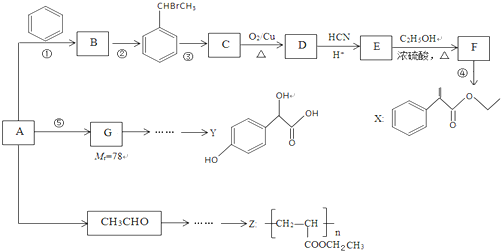
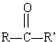 $→_{H+}^{HCN}$
$→_{H+}^{HCN}$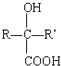 R或R′可以是烃基或氢原子
R或R′可以是烃基或氢原子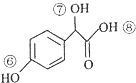 的说法正确的是AD.
的说法正确的是AD. .
.