题目内容
20.工业上,从海水中提取溴常用如下方法:(1)将海水浓缩后,向其中通入氯气,将溴化物氧化,以溴化钠为例,用化学方程式表示该反应Cl2+2NaBr=2NaCl+Br2,该反应属于四种基本反应类型中的置换反应,也属于氧化还原反应(选填“氧化还原反应”或“非氧化还原反应”).
(2)向上述混合液中吹入热空气,将 生成的溴吹出,是根据溴的沸点比水的沸点低(选填“低”或“高”)的性质,吹出的溴用碳酸钠溶液吸收,这一过程的化学方程式为3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,生成物中溴元素的化合价分别为-1,+5价. 这一类型的化学反应称为歧化反应.
分析 (1)氯气氧化溴化钠生成溴单质和氯化钠,该反应是四种基本反应中的置换反应,反应前后元素化合价发生变化的反应是氧化还原反应;
(2)溴单质是易挥发的物质,依据化学方程式中物质中元素化合价代数和为0计算标注元素化合价;
解答 解:(1)将海水浓缩后,向其中通入氯气,将溴化物氧化,以溴化钠为例,发生反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2,该反应属于四种基本反应类型中的置换反应,也属于氧化还原反应,
故答案为:Cl2+2NaBr=2NaCl+Br2,置换,氧化还原;
(2)向上述混合液中吹入热空气,将生成的溴吹出,是根据溴的沸点比水的沸点低的性质,吹出的溴用碳酸钠溶液吸收,这一过程的化学方程式为3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,生成物中溴元素的化合价分别是NaBr中 溴元素为-1价,NaBrO3中溴元素化合价+5价,
故答案为:低,-1,+5;
点评 本题考查了氯气及其化合物性质、制备方法,氧化还原反应实质理解,题目较简单.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
10.将少量氯水加入盛有KI溶液的试管中,加入适量的CCl4,然后振荡,静置,产生的现象是( )
| A. | 溶液分层,上层几乎无色,下层紫红色 | |
| B. | 溶液分层,上层紫红色,上层几乎无色 | |
| C. | 溶液分层,上层几乎无色,下层橙红色 | |
| D. | 溶液呈紫红色 |
11.下列说法正确的是( )
| A. | 摩尔是物质质量的单位 | B. | 1 mol气体所占的体积一定是22.4L | ||
| C. | 1mol水质量为18g | D. | 氢气的摩尔质量是2g |
8.下列说法正确的是( )
| A. | CO2的比例模型为 | |
| B. | H2O2的电子式是H:O:O:H | |
| C. | 甲烷的结构式为CH4 | |
| D. | 熔融状态下NaHSO4的电离方程式为NaHSO4=Na++HSO4- |
5.下列反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠放入水中:Na+H2O═Na++OH-+H2↑ | |
| D. | 氢氧化镁溶于盐酸:Mg(OH)2+2H+═Mg2++2H2O. |
12.下列钠的化合物与其性质或用途不相符的是( )
| A. | Na2O2--淡黄色固体,可作漂白剂 | |
| B. | Na2O--白色固体,性质不稳定加热可生成Na2O2 | |
| C. | NaCl--用于调味,医疗上作生理盐水 | |
| D. | Na2CO3--性质稳定,可用于治疗胃酸过多 |
9.胡妥油(D)用作香料的原料,它可由A合成得到:下列说法正确的是( )
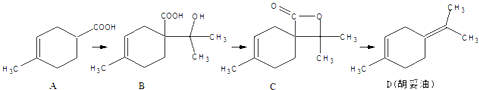

| A. | 若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于取代反应 | |
| B. | 有机物D分子中所有碳原子一定共面 | |
| C. | 有机物C的所有同分异构体中不可有芳香族化合物存在 | |
| D. | 有机物B既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
10.下列有关氨气或氨水的相关说法正确的是( )
| A. | 表面附着氨水的碳素钢在空气中主要发生析氢腐蚀 | |
| B. | 反应NH3(g)+HCl(g)?NH4Cl (s)的△H<0,△S<0 | |
| C. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH>7 | |
| D. | 向2NH3(g)?N2(g)+3H2(g)的平衡体系中加入催化剂,NH3的平衡转化率增大 |
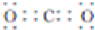 .
.