题目内容
11.下列说法正确的是( )| A. | 摩尔是物质质量的单位 | B. | 1 mol气体所占的体积一定是22.4L | ||
| C. | 1mol水质量为18g | D. | 氢气的摩尔质量是2g |
分析 A、摩尔是物质的量的单位;
B、标准状况下1 mol气体所占的体积一定是22.4L;
C、依据m=nM计算得到;
D、摩尔质量单位为g/mol.
解答 解:A、摩尔是物质的量的单位,故A错误;
B、温度压强不知,1 mol气体所占的体积不是22.4L,故B错误;
C、1mol水质量为1mol×18g/mol=18g,故C正确;
D、氢气的摩尔质量是2g/mol,故D错误;
故选C.
点评 本题考查了物质的量、摩尔质量、气体摩尔体积的概念分析判断,理解概念含义是关键,题目较简单.

练习册系列答案
相关题目
1.已知在常温下测得浓度均为0.1mol•L-1的下列四种溶液的pH如下表:
(1)用离子方程式表示NaClO溶液的pH=9.7的原因ClO-+H2O?HClO+OH-.
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
| 溶质 | NaHCO3 | Na2CO3 | NaF | NaClO |
| pH | 8.4 | 11.6 | 7.5 | 9.7 |
(2)根据盐溶液的pH,可知①Ka(HClO) ②Ka1(H2CO3) ③Ka(HF) ④Ka2(H2CO3)的大小顺序为③②①④.
(3)将少量CO2通入NaClO溶液中,写出该反应的离子方程式:CO2+H2O+ClO-=HClO+HCO3-.
(4)将CO2通入0.1mol•L-1的Na2CO3溶液中至中性,则溶液中2c(CO32-)+c(HCO3-)=0.2mol•L-1.
2.东汉著名的炼丹理论家魏伯阳所著的《周易参同契》提出:“胡粉投火中,色坏还为铅”,已知胡粉主要成分是2PbCO3•Pb(OH)2.下列有关说法正确的是( )
| A. | 胡粉中的Pb显+4价 | |
| B. | 这里的“火”中含有炭 | |
| C. | 此过程中可能发生了化合反应 | |
| D. | 在元素周期表中铅与炭都位于第ⅥA族 |
19.用一种试剂除去下列各组物质中所含有的少量杂质(括号内为杂质),其中除杂方法正确的是( )
| A. | CO2(SO2):通过饱和Na2CO3溶液,洗气 | |
| B. | Cl2(HCl):通过NaOH固体,吸收 | |
| C. | BaCl2溶液(HCl):加入足量BaCO3,过滤 | |
| D. | FeCl3溶液(CuCl2):通入足量Fe,过滤 |
6.下列实验装置能达到实验目的是( )
| A. |  进行喷泉实验 | B. |  加热熔融NaOH固体 | ||
| C. |  验证镁片与稀盐酸反应放热 | D. |  测定过氧化氢的纯度 |
16.下列说法正确的是( )
| A. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| B. | 电解精炼铜时,每转移1mol电子,阳极溶解铜的质量为32g | |
| C. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 | |
| D. | 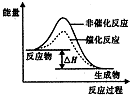 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
3.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 100mL、1moL•L-1的ALCL3溶液中,含A13+的数目为0.1 NA | |
| B. | 足量Fe与0.1 mol CL2充分反应,转移的电子数目为0.3 NA | |
| C. | 在02参与的反应中,1mol 02作氧化剂时得到的电子数目一定为4 NA | |
| D. | 2.8g乙烯与一氧化碳的混合气体,所含分子数目为0.1 NA |
1.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 一定条件下,1 mol N2与足量H2反应生成NH3,转移电子6NA | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |