题目内容
8.下列说法正确的是( )| A. | CO2的比例模型为 | |
| B. | H2O2的电子式是H:O:O:H | |
| C. | 甲烷的结构式为CH4 | |
| D. | 熔融状态下NaHSO4的电离方程式为NaHSO4=Na++HSO4- |
分析 A.二氧化碳为直线型结构,不是V型;
B.电子式中漏掉了氧原子的2对未成键电子对;
C.结构式中需要用短线表示出所有的共用电子对;
D.熔融状态下硫酸氢钠电离出钠离子和硫酸氢根离子.
解答 解:A.二氧化碳分子中含有两个碳氧双键,为直线型结构,二氧化碳正确的比例模型为: ,故A错误;
,故A错误;
B.双氧水为共价化合物,分子中含有2个O-H键和1个O-O键,其电子书为 ,故B错误;
,故B错误;
C.甲烷是碳原子和氢原子间通过共价单键形成的空间正四面体结构,结构式为: ,故C错误;
,故C错误;
D.熔融状态下NaHSO4电离出钠离子和硫酸氢根离子,其电离方程式为:NaHSO4=Na++HSO4-,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、比例模型、结构式、电离方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2.在该反应中( )
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 该化学离子方程式:CO32-+2S2-+4SO2═3S2O32-+CO2 |
19.用一种试剂除去下列各组物质中所含有的少量杂质(括号内为杂质),其中除杂方法正确的是( )
| A. | CO2(SO2):通过饱和Na2CO3溶液,洗气 | |
| B. | Cl2(HCl):通过NaOH固体,吸收 | |
| C. | BaCl2溶液(HCl):加入足量BaCO3,过滤 | |
| D. | FeCl3溶液(CuCl2):通入足量Fe,过滤 |
16.下列说法正确的是( )
| A. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| B. | 电解精炼铜时,每转移1mol电子,阳极溶解铜的质量为32g | |
| C. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 | |
| D. | 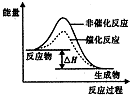 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
3.NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 100mL、1moL•L-1的ALCL3溶液中,含A13+的数目为0.1 NA | |
| B. | 足量Fe与0.1 mol CL2充分反应,转移的电子数目为0.3 NA | |
| C. | 在02参与的反应中,1mol 02作氧化剂时得到的电子数目一定为4 NA | |
| D. | 2.8g乙烯与一氧化碳的混合气体,所含分子数目为0.1 NA |
13.下列溶液中各组离子一定能够大量共存的是( )
| A. | 含有Fe3+的溶液:Na+、K+、SCN-、NO3- | |
| B. | 能使pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、CO32-、OH- | |
| D. | 能使淀粉KI试纸显蓝色的溶液:K+、SO42-、Fe2+、NH4+ |
17.在一个密闭容器中发生如下反应:2SO2(g)+O2(g)?2SO3(g),反应过程中某一时刻测得SO2、O2、SO3的浓度分别为:0.2mol•L-1、0.2mol•L-1、0.2mol•L-1,当反应达到平衡时,可能出现的数据是( )
| A. | c(SO3)=0.4 mol•L-1 | B. | c(SO2)=c(SO3)=0.15 mol•L-1 | ||
| C. | c(SO2)=0.25 mol•L-1 | D. | c(SO2)+c(SO3)=0.5 mol•L-1 |
18.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 在12 g单层石墨中,含六元环的数目为1NA | |
| B. | 50mL 18.4mol•L-1浓硫酸与足量铜加热充分反应,生成SO2分子的数目为0.46 NA | |
| C. | 42 g由乙烯和环丙烷组成的混合气体中,碳氢键的数目为6NA | |
| D. | 1mol过氧化钠与足量CO2充分反应,转移的电子数为2NA |