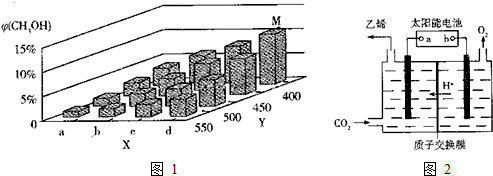
题目内容
1.X、Y均为第3周期主族非金属元素,且Y的族序数大于X的族序数.下列说法正确的是( )| A. | 原子序数:X>Y | |
| B. | 非金属性:X>Y | |
| C. | 最高价氧化物对应的水化物酸性:X>Y | |
| D. | 原子半径:X>Y |
分析 X、Y均为第3周期主族非金属元素,且Y的族序数大于X的族序数,则原子序数:X<Y,非金属性:X<Y,
A.同一周期中,族序数越大,原子序数越大;
B.同一周期中,原子序数越大,非金属性越强;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.同一周期中,原子序数越大,原子半径越小.
解答 解:X、Y均为第3周期主族非金属元素,且Y的族序数大于X的族序数,则原子序数:X<Y,非金属性:X<Y,
A.根据分析可知,原子序数大小为:X<Y,故A错误;
B.同一周期中,原子序数越大,非金属性越强,则非金属性:X<Y,故B错误;
C.非金属性:X<Y,则最高价氧化物对应水合物的酸性:X<Y,故C错误;
D.同一周期中,原子序数越大,原子半径越小,则原子半径X>Y,故D正确;
故选D.
点评 本题考查了元素周期律与元素周期表的综合应用,题目难度中等,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某化学反应2A(g)?B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0.反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述实验数据,完成下列填空:
(1)在实验1中,反应在10至20min时间内,反应物A的平均速率为0.013mol/(L•min).
(2)在实验2中,A的初始浓度C2=1.0mol/L,反应经20minA的浓度就不再发生变化,进而可推测实验2中隐含的条件是加入了催化剂.
(3)在实验3中,A的初始浓度C3>1.0mol/L(填>、=、<).
(4)比较实验4和实验1,可推测该反应是吸热反应(选填“吸热”、“放热”).理由是升高温度,A的平衡浓度减小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应.
| 浓 时间 度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10至20min时间内,反应物A的平均速率为0.013mol/(L•min).
(2)在实验2中,A的初始浓度C2=1.0mol/L,反应经20minA的浓度就不再发生变化,进而可推测实验2中隐含的条件是加入了催化剂.
(3)在实验3中,A的初始浓度C3>1.0mol/L(填>、=、<).
(4)比较实验4和实验1,可推测该反应是吸热反应(选填“吸热”、“放热”).理由是升高温度,A的平衡浓度减小,说明升高温度平衡向正反应方向移动,故正反应是吸热反应.
12.关于氢键和分子间作用力,下列说法不正确的是( )
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 在氨水中水分子和氨分子之间也存在着氢键 | |
| D. | 分子间作用力较弱,破坏它所需能量较少 |
9.下列设计的实验方案能达到实验目的是( )
| A. | 将苯和溴水混合后加入Fe粉制溴苯 | |
| B. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂已完全反应 | |
| C. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热煮沸,观察是否出现红色沉淀 | |
| D. | 探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
16.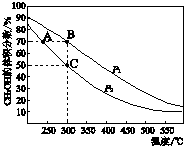 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
 CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )
CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g)?CH3OH(g).按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示.下列说法中,正确的是( )| A. | P1<P2 | B. | 该反应的△H>0 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
13.下列离子反应方程式正确的是( )
| A. | 向Al2(S04)3溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++N03-=3Fe3++NO↑+2H2O | |
| D. | 碱性锌锰电池正极反应:2MnO2+2H2O+2e一=2MnOOH+2OH- |
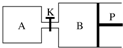 甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0
甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0