题目内容
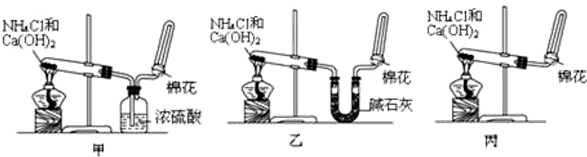
8.根据下列实验设计及有关现象,所得结论正确的是( )| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B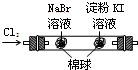 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D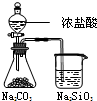 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.这两个原电池中,都是较活泼的金属作负极,较不活泼的金属作正极,正极上氢离子得电子生成氢气;
B.氯气和碘离子反应生成碘;
C.溶解性大的物质能转化为溶解性小的物质;
D.HCl也能和硅酸钠反应生成硅酸.
解答 解:A.这两个原电池中,都是较活泼的金属作负极,较不活泼的金属作正极,正极上氢离子得电子生成氢气,左边烧杯中铁为正极、右边烧杯中铜为正极,所以活动性:Al>Fe>Cu,故A错误;
B.和溴化钠反应的氯气能和碘化钾反应生成碘,从而造成干扰,所以不能Cl2>Br2>I2,故B错误;
C.溶解度大的物质能转化为溶解度小的物质,白色固体先变为淡黄色,说明AgCl变成了AgBr,后变为黑色Ag2S,即溶解性:AgCl>AgBr>Ag2S,故C正确;
D.依据强酸制弱酸的原理,锥形瓶中有气体产生,说明盐酸的酸性比碳酸强,浓盐酸易挥发,氯化氢和二氧化碳都进入硅酸钠溶液,不能证明产生的硅酸沉淀一定是二氧化碳反应的结果,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及酸性强弱比较、溶解度大小比较、氧化性强弱比较、金属性强弱比较等知识点,明确实验原理、物质性质是解本题关键,注意D中HCl、B中氯气对实验的干扰,为易错点.

练习册系列答案
相关题目
18.关于如图所示实验装置及说法中正确的是( )
| A. | 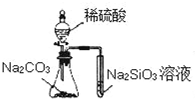 实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 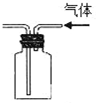 实验装置排空气法收集CO2气体 | |
| C. | 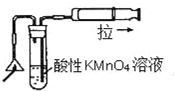 可以检验火柴燃烧生成的SO2气体 | |
| D. | 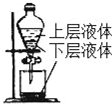 提取海带中的碘 |
13.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA | |
| B. | 常温下,1L0.1mol•L-1CuSO4溶液中粒子总数小于0.2NA | |
| C. | 1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3NA |
20.短周期元素R、X、Y、W的部分信息如表所示:
已知Y和W位于同一周期.下列有关说法不正确的是( )
| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
14.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( )
| A. | 电子排布式为:1s22s22p63s23p63d34s2 | |
| B. | 该元素为VB | |
| C. | 元素为ⅢB族元素 | |
| D. | 该元素属于过渡元素 |
15.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅.以下是实验室制备SiCl4的装置示意图.

已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是浓硫酸:装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(2)装置A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.A装置中,有一处明显错误是无石棉网.
(3)装置D的硬质玻璃管中发生反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:

已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是浓硫酸:装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(2)装置A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.A装置中,有一处明显错误是无石棉网.
(3)装置D的硬质玻璃管中发生反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |
 其合成路线如下:
其合成路线如下: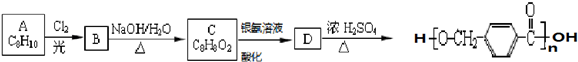
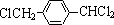 ,其中的官能团名称为氯原子.
,其中的官能团名称为氯原子.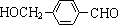 +2Ag(NH3)2OH $\stackrel{△}{→}$
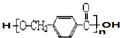
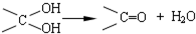
+2Ag(NH3)2OH $\stackrel{△}{→}$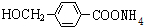 +2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n
+2Ag↓+3NH3+H2O.由D生成高分子化合物的反应n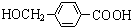 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$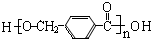 +(n-1)H2O.
+(n-1)H2O.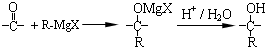
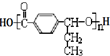 ,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)
,在合成过程中所用的格氏试剂的化学式为CH3CH2MgX(用X表示卤原子),合成过程中涉及到的有机化学反应类型有ACD(填编号)