题目内容
 某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图所示.下列有关叙述不正确的是( )| A、该反应的△H>0 |
| B、E1表示正反应的活化能 |
| C、E2表示逆反应的活化能 |
| D、使用催化剂降低正反应的活化能,不能降低逆反应的活化能 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、图象分析反应物能量低于生成物能量,反应是吸热反应;
B、正反应活化能是反应物吸收能量变化为活化分子发生有效碰撞的能量,图象中E1为正反应活化能;
C、逆反应的活化能是从逆向进行,引发反应需要的能量,E2表示逆反应的活化能;
D、催化剂同等程度改变正逆反应速率,改变活化能.
B、正反应活化能是反应物吸收能量变化为活化分子发生有效碰撞的能量,图象中E1为正反应活化能;
C、逆反应的活化能是从逆向进行,引发反应需要的能量,E2表示逆反应的活化能;
D、催化剂同等程度改变正逆反应速率,改变活化能.
解答:
解:A、图象分析反应物能量低于生成物能量,反应是吸热反应,△H>0,故A正确;
B、图象中E1为正反应活化能,故B正确;
C、逆反应的活化能是从逆向进行,引发反应需要的能量,图象中E2表示逆反应的活化能,故C正确;
D、催化剂同等程度改变正逆反应速率,同等程度改变活化能,故C错误;
故选D.
B、图象中E1为正反应活化能,故B正确;
C、逆反应的活化能是从逆向进行,引发反应需要的能量,图象中E2表示逆反应的活化能,故C正确;
D、催化剂同等程度改变正逆反应速率,同等程度改变活化能,故C错误;
故选D.
点评:本题考查了化学变化过程中能量变化的分析的,主要是活化能概念的理解应用,掌握图象分析方法是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于氯水的叙述正确的是( )
| A、新制氯水呈黄绿色 |
| B、新制的氯水中只含Cl2和H2O分子 |
| C、新制氯水需置于无色试剂瓶中保存 |
| D、光照氯水有气泡逸出,该气体是Cl2 |
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,44 g C3H8中含有的碳碳单键数为3NA |
| B、1mol羟基中电子数为10NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D、标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
一定条件下,可逆反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,有关该反应的叙述正确的是( )
| A、正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间 |
| B、将lmol N2和H2 3mol充分反应达到平衡时,放出的热量等于92.4kJ |
| C、平衡时增大氮气的浓度,达新平衡时N2转化率减小,H2转化率增大 |
| D、当c(N2):c(H2):c(NH3)=1:3:2时,反应就达到平衡状态 |
下列有关元素周期表中元素性质的叙述中不正确的是( )
| A、同主族元素从上到下,金属性逐渐增强 |
| B、主族元素的最高正化合价均等于它所在的主族序数 |
| C、同周期的元素(稀有气体例外)的原子半径越小,越难失去电子 |
| D、元素的非金属性越强,其气态氢化物水溶液的酸性越强 |
在下列透明溶液中,因氧化还原反应而不能大量共存的离子组是( )
| A、Na+、K+、MnO4-、SO42- |
| B、Cl-、Al3+、AlO2-、Na+ |
| C、Na+、CH3COO-、H+、K+ |
| D、K+、I-、Na+、Fe3+ |
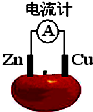 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.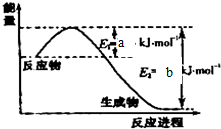 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答: