题目内容
将下列各组物质按酸、碱、盐分类顺次排列.其中正确的是( )
| A、硫酸,纯碱,醋酸钠 |
| B、硝酸,烧碱,纯碱 |
| C、盐酸,乙醇,醋酸钠 |
| D、盐酸,熟石灰,苛性钠 |
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:根据酸碱盐的概念分析,酸是指电离时生成的阳离子全部是氢离子的化合物;碱是指电离时生成的阴离子全部是氢氧根离子的化合物;盐是指由金属离子(或铵根离子)和酸根离子组成的化合物.
解答:
解:A、硫酸属于酸,纯碱属于盐不属于碱,醋酸钠属于盐,故A错误;
B、硝酸属于酸,烧碱属于碱,纯碱是碳酸钠属于盐,故B正确;
C、盐酸属于混合物,乙醇属于醇,醋酸钠属于盐,故C错误;
D、盐酸属于混合物,熟石灰是氢氧化钙属于盐,苛性钠是氢氧化钠属于碱,故D错误.
故选B.
B、硝酸属于酸,烧碱属于碱,纯碱是碳酸钠属于盐,故B正确;
C、盐酸属于混合物,乙醇属于醇,醋酸钠属于盐,故C错误;
D、盐酸属于混合物,熟石灰是氢氧化钙属于盐,苛性钠是氢氧化钠属于碱,故D错误.
故选B.
点评:本题考查了酸碱盐的概念,解答本题要充分理解酸碱盐的概念的含义,只有这样才能对各种物质进行正确的分类,题目较简单.

练习册系列答案
相关题目
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3 +3F2=NF3 +3NH4F,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF.下列说法正确的是( )
| A、制取NF3的反应中,氧化剂与还原剂的物质的量之比为1:3 |
| B、NF3在潮湿的空气中泄漏会产生红棕色气体 |
| C、若在制取NF3的反应中有2molNH3参加反应,转移电子的物质的量为12mol |
| D、它在潮湿的环境中NF3是氧化剂,H2O是还原剂 |
氧化还原反应的实质是( )
| A、分子中的原子重新组合 |
| B、氧元素的得失 |
| C、电子的转移 |
| D、化合价的改变 |
NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、常温常压下,44 g C3H8中含有的碳碳单键数为3NA |
| B、1mol羟基中电子数为10NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D、标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
化学在工业生产和日常生活中有着重要的应用.下列说法正确的是( )
| A、CO2、NO2和SO2都是酸性氧化物,都是大气污染物 |
| B、常温下,铁在浓硫酸、浓硝酸中均能发生钝化,均能用铁罐储运 |
| C、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| D、NaClO和明矾都能作消毒剂或净水剂,加入酚酞试液均显红色 |
一定条件下,可逆反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,有关该反应的叙述正确的是( )
| A、正催化剂能加快正反应速率v正,不影响v逆,所以缩短了反应达平衡所需的时间 |
| B、将lmol N2和H2 3mol充分反应达到平衡时,放出的热量等于92.4kJ |
| C、平衡时增大氮气的浓度,达新平衡时N2转化率减小,H2转化率增大 |
| D、当c(N2):c(H2):c(NH3)=1:3:2时,反应就达到平衡状态 |
下列有关元素周期表中元素性质的叙述中不正确的是( )
| A、同主族元素从上到下,金属性逐渐增强 |
| B、主族元素的最高正化合价均等于它所在的主族序数 |
| C、同周期的元素(稀有气体例外)的原子半径越小,越难失去电子 |
| D、元素的非金属性越强,其气态氢化物水溶液的酸性越强 |
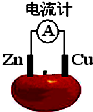 理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.
理论上任何自发的氧化还原反应都可以设计成原电池.如使用锌电极、铜电极、橙子(酸性介质)设计如下水果电池.