题目内容
4.下列对碱金属性质的叙述中,正确的是( )| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 碱金属单质都能与盐酸反应放出氢气 | |
| D. | 单质的熔、沸点随着原子序数的增加而升高 |
分析 A.铯是金黄色金属,Rb和铯密度大于水;
B.锂在空气中燃烧生成氧化锂;
C.碱金属为活泼金属,与盐酸反应生成盐和氢气;
D.金属熔沸点从上到下熔沸点依次降低.
解答 解:A.铯是金黄色金属,其他碱金属都是银白色的柔软金属,Rb和铯密度大于水,故A错误;
B.锂在空气中燃烧生成氧化锂,得不到过氧化物,故B错误;
C.碱金属为活泼金属,与盐酸反应生成盐和氢气,故C正确;
D.碱金属熔沸点从上到下熔沸点依次降低,故D错误;
故选:C.
点评 本题考查了碱金属的性质,把握同主族元素性质的相似性和递变性是解题关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
14.铅蓄电池反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O.下列说法中正确的是( )
| A. | 放电时,蓄电池内电路中H+向负极移动 | |
| B. | 放电时,每通过lmol电子,蓄电池就要消耗2molH2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-→Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
15.下列说法正确的是( )
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 羟基(-OH)和氢氧根(OH-)所含电子数相等 | |
| C. | 总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
12.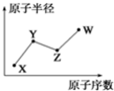 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.己知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1,下列说法正确的是( )| A. | Y、Z、W处于同一周期 | |
| B. | X、Y、Z三种元素形成的化合物均为强酸 | |
| C. | Y的氢化物可用于检验W的单质是否泄漏 | |
| D. | 如W的单质泄漏,可以用湿毛巾蘸Y的氢化物的水溶液逃生 |
19.下列电子式书写不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列叙述正确的是( )
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 一定条件下醋酸溶液的导电能力可能比稀硫酸强 | |
| C. | SO2的水溶液能导电,所以SO2是电解质 | |
| D. | 金刚石不导电,因此金刚石是非电解质 |
16.NA表示阿伏加德罗常数的值,则关于热化学方程式:C2H2(g)+2.5O2(g)═2CO2(g)+H2O(l)△H=-1 300kJmol-1的说法中,正确的是( )
| A. | 当5NA个电子转移时,该反应放出650 kJ的热量 | |
| B. | 当1NA个水分子生成且为气体时,放出多于1300 kJ的热量 | |
| C. | 当2 NA个碳氧双键生成时,放出1300 kJ的热量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300kJ的热量 |
13.化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A. | 明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 | |
| C. | Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 | |
| D. | 水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
14.对于反应N2+O2?2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |