题目内容
19.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在2L的密闭容器中进行,2s后,NH3减少了1.2mol.求:(1)2s内,NH3的化学反应速率为0.3mol/(L.s),
(2)O2的化学反应速率0.375mol/(L.s),
(3)NO的化学反应速率0.3mol/(L.s),
(4)H2O的化学反应速率0.45mol/(L.s),
(5)V(NH3):V(O2):V(NO):V(H2O)=4:5:4:6.
分析 在2L的密闭容器中进行,2s后,NH3减少了1.2mol,则v(NH3)=$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol/(L.s),结合反应速率等于化学计量数之比计算.
解答 解:(1)2s内,NH3的化学反应速率为$\frac{\frac{1.2mol}{2L}}{2s}$=0.3mol/(L.s),故答案为:0.3mol/(L.s);
(2)由速率之比等于反应速率之比可知,O2的化学反应速率为0.3mol/(L.s)×$\frac{5}{4}$=0.375mol/(L.s),故答案为:0.375mol/(L.s);
(3)NO的化学反应速率等于氨气的反应速率,均为0.3mol/(L.s),故答案为:0.3mol/(L.s);
(4)由速率之比等于反应速率之比可知,H2O的化学反应速率为0.3mol/(L.s)×$\frac{6}{4}$=0.45mol/(L.s),故答案为:0.45mol/(L.s);
(5)由速率之比等于反应速率之比可知,V(NH3):V(O2):V(NO):V(H2O)=4:5:4:6,故答案为:4:5:4:6.
点评 本题考查化学反应速率与化学计量数的关系,为高频考点,把握反应速率公式、速率与化学计量数成正比为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
9.一定质量的某有机物和足量的钠反应,可得气体Va L,相同质量的该有机物与足量的碳酸氢钠溶液反应,可得气体Vb L.若同温同压下Va=Vb>0,该有机物可能是( )
| A. | HO(CH2)2CHO | B. | CH3COOH | C. | HOOCCOOH | D. | HO(CH2)2COOH |
14.某元素R的最外层电子数是次外层电子数的2倍,由此可以判断( )
| A. | R一定是第2周期元素 | |
| B. | R一定是VA族元素 | |
| C. | R的气态氢化物一定比同周期其他元素气态氢化物稳定 | |
| D. | R气态氢化物化学式为H2R |
4.古尔邦节后,乌市一中的艾同学带着快乐的心情返回学校.当来到实验室时,意外地发现实验桌上有瓶敞口放置已久的NaOH溶液,由此,激发了他的探究欲望.
【提出问题】这瓶NaOH溶液一定变质了,其变质程度如何呢?
【提出猜想】艾同学的猜想:NaOH溶液部分变质
你的新猜想:NaOH溶液全部变质.
【实验探究】艾同学设计如下实验来验证自己的猜想,请填写艾同学实验时的现象
假设你的猜想正确,并按艾同学的实验方案进行实验,则你观察到的实验现象是:白色沉淀,酚酞试液变红或白色沉淀,酚酞试液不变色.
上述实验过程中涉及的离子反应方程式为:Ca2++CO32-=CaCO3↓.
【实验反思】
(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代艾同学实验中CaCl2溶液的是③④(填序号).
(2)艾同学第二次滴加的试剂除用指示剂外,还可以用硫酸铜溶液(或氯化铁溶液、NH4Cl溶液等)替代,相应的离子反应方程式为:Cu2++2OH-=Cu(OH)2↓.
【拓展应用】保存NaOH溶液的方法是密封保存.
【提出问题】这瓶NaOH溶液一定变质了,其变质程度如何呢?
【提出猜想】艾同学的猜想:NaOH溶液部分变质
你的新猜想:NaOH溶液全部变质.
【实验探究】艾同学设计如下实验来验证自己的猜想,请填写艾同学实验时的现象
| 实验步骤 | 现象 | 结论 |
| 取少量NaOH溶液样品于试管中,先滴加足量的CaCl2溶液,然后再滴加酚酞试液. | NaOH溶液部分变质 |
上述实验过程中涉及的离子反应方程式为:Ca2++CO32-=CaCO3↓.
【实验反思】
(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代艾同学实验中CaCl2溶液的是③④(填序号).
(2)艾同学第二次滴加的试剂除用指示剂外,还可以用硫酸铜溶液(或氯化铁溶液、NH4Cl溶液等)替代,相应的离子反应方程式为:Cu2++2OH-=Cu(OH)2↓.
【拓展应用】保存NaOH溶液的方法是密封保存.
11.图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )
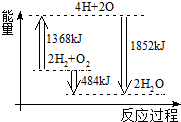

| A. | 拆开2 mol H2(g)和1 mol O2(g)中的化学键成为H、O原子,共放出1368 kJ能量 | |
| B. | 由H、O原子形成2 mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),共吸收484 kJ能量 | |
| D. | 2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量 |
8.下列电子排布式对应的元素原子,半径最大的是( )
| A. | 1s22s22p63s23p64s1 | B. | 1s22s22p63s23p63d104s1 | ||
| C. | 1s22s22p63s23p63d104s24p5 | D. | 1s22s22p63s23p63d54s2 |