题目内容
8.下列电子排布式对应的元素原子,半径最大的是( )| A. | 1s22s22p63s23p64s1 | B. | 1s22s22p63s23p63d104s1 | ||
| C. | 1s22s22p63s23p63d104s24p5 | D. | 1s22s22p63s23p63d54s2 |
分析 根据各原子的和我电子排布式可知,四种原子都含有4个电子层,说明位于同一周期,根据元素周期律可知,原子序数越大,原子半径越小,据此进行解答.
解答 解:A.1s22s22p63s23p64s1含有4个电子层,位于第四周期,原子序数=核电荷数=核外电子总数=19;
B.1s22s22p63s23p63d104s1含有4个电子层,位于第四周期,原子序数=核电荷数=核外电子总数数=37;
C1s22s22p63s23p63d104s24p5含有4个电子层,位于第四周期,原子序数=核电荷数=核外电子总数=43;
D.1s22s22p63s23p63d54s2含有4个电子层,位于第四周期,原子序数=核电荷数=核外电子总数=33;
根据元素周期律可知,同一周期元素,原子序数越大,原子半径越小,所以原子半径最大的为A,
故选A.
点评 本题考查了原子半径比较、核外电子排布,题目难度不大,明确判断原子半径大小的规律为解答关键,注意掌握核外电子排布原子原则,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.化合物M叫假蜜环菌素(结构如图),它是香豆素类天然化合物.对M的性质叙述错误的是( )
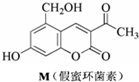

| A. | M与Br2可以发生取代反应,但不能发生加成反应 | |
| B. | M既能与FeCl3发生显色反应,也能与CH3COOH发生反应 | |
| C. | 1molM最多消耗3mol NaOH | |
| D. | 1molM在催化剂作用下最多能与5molH2发生加成反应 |
16.某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如表(实验方案与实验现象没对应)
请你帮助该同学完成实验报告:
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
13.某溶液可能含有NH4+、K+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,现取100mL溶液先加入足量氯水,溶液呈无色,然后滴加足量BaCl2溶液,得到沉淀4.66g,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为1.12L.
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
已知:SO32-+Cl2+H2O═SO42-+2Cl-+2H+;2Fe3++2I-═2Fe2++I2
根据上述实验,以下推测正确的是( )
| A. | 原溶液一定存在NH4+、I- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、Fe3+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液所有的离子组成 |
20.下列说法不正确的是( )
| A. | 建造三峡大坝使用了大量水泥,水泥属于硅酸盐材料 | |
| B. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 |
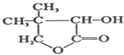 ,G的合成路线如下:
,G的合成路线如下: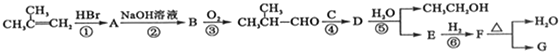
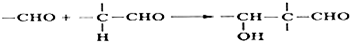
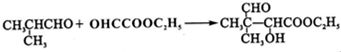 .
.