题目内容
7.探究小组用滴定法测定CuSO4•5H2O(Mr=250)含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-═CuY2-+2H+(1)写出计算CuSO4•5H2O质量分数的表达式w=$\frac{cmol/L×b×1{0}^{-3}L×250g/mol×5}{ag}$×100%;
(2)下列操作会导致CuSO4•5H2O含量的测定结果偏高的是c.
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子.
分析 (1)依据滴定实验和反应离子方程式,结合元素守恒计算得到;
(2)滴定实验误差分析依据标准溶液消耗的多少进行分析判断.
解答 解:(1)滴定反应为:Cu2++H2Y2-=CuY2-+2H+,铜离子物质的量和标准液物质的量相同:cmol/L×b×10-3L=bc×10-3mol;依据元素守恒可得:
20ml溶液中含有的CuSO4•5H2O物质的量为:bc×10-3mol,
则100ml溶液中含硫酸铜晶体的物质的量为:bc×10-3mol×$\frac{100ml}{20ml}$=5bc×10-3mol,
所以CuSO4•5H2O质量分数的表达式为:$\frac{cmol/L×b×1{0}^{-3}L×250g/mol×5}{ag}$×100%;
故答案为:$\frac{cmol/L×b×1{0}^{-3}L×250g/mol×5}{ag}$×100%;
(2)a.未干燥锥形瓶对实验结果无影响,故a错误;
b.滴定终点时滴定管尖嘴中产生气泡说明消耗标准液读数偏小,结果偏低,故b错误;
c.未除净可与EDTA反应的干扰离子,消耗标准液多,结果偏高,故c正确;
故答案为:c.
点评 本题通过制备硫酸铜晶体,考查了制备实验方案的设计,试题涉及硫酸铜晶体的制备方法、中和滴定的简单计算和误差的分析,题目难度中等,明确制备原理为解答本题关键,试题充分考查了学生的分析、理解能力及化学实验、化学计算能力.

练习册系列答案
相关题目
18.化合物M叫假蜜环菌素(结构如图),它是香豆素类天然化合物.对M的性质叙述错误的是( )
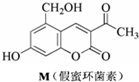

| A. | M与Br2可以发生取代反应,但不能发生加成反应 | |
| B. | M既能与FeCl3发生显色反应,也能与CH3COOH发生反应 | |
| C. | 1molM最多消耗3mol NaOH | |
| D. | 1molM在催化剂作用下最多能与5molH2发生加成反应 |
2.下列表示物质结构的化学用语或模型正确的是( )
| A. | C原子外围电子排布图: | B. | 硫原子结构示意图: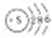 | ||
| C. | 二氧化硅的分子式:SiO2 | D. | 苯的比例模型: |
16.某学生做元素性质递变实验时自己设计了一套方案,并记录了有关实验现象如表(实验方案与实验现象没对应)
请你帮助该同学完成实验报告:
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
| 实验方案 |
| 1.用砂纸打磨后的镁带加适量水加热,再向反应后溶液中滴加酚酞 |
| 2.钠与滴有酚酞试液的冷水反应 |
| 3.镁带与2mol/L的盐酸反应 |
| 4.铝条与2mol/L的盐酸反应 |
| 5.向氯化铝溶液中滴加氢氧化钠溶液至过量 |
| 实验现象 |
| (A) |
| (B)反应不十分强烈,产生气体 |
| (C)剧烈反应,产生气体 |
| (D)生成白色胶状沉淀,然后沉淀消失 |
| (E)产生的气体可在空气中燃烧,溶液变成浅红色 |
(1)实验的目的探究同周期元素金属性的递变规律.
(2)实验仪器:①试管②酒精灯③胶头滴管④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等
(3)实验内容:
与实验方案1至5对应的实验现象依次为E、A、C、B、D(填字母编号).实验现象(A)为:钠浮在水面上,熔化化成小球,四处游动,发出嘶嘶响声,溶液变红.
(4)实验结论同周期元素从左到右金属性减弱.
 ,C和E形成化合物的电子式
,C和E形成化合物的电子式 .
.