题目内容
9.实验室常用KMnO4和浓盐酸的反应来制取氯气.化学反应方程式如下:2KMnO4+16HCl→2KCl+2MnCl2+5Cl2↑+8H2O若产生的氯气为11.2L(已折算为标准状况).试计算:参加反应的HCl的物质的量是1.6mol.被氧化的HCl的物质的量是1mol.分析 制取标准状况下的氯气11.2L,其物质的量的为$\frac{11.2L}{22.4L/mol}$=0.5mol,由2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O可知,参加反应的HCl的物质的量是$\frac{16}{5}×0.5$=1.6mol,被氧化的盐酸中的氯离子全部转化为氯气,据反应方程式计算.
解答 解:制取标准状况下的氯气11.2L,其物质的量的为$\frac{11.2L}{22.4L/mol}$=0.5mol,由2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O可知,被氧化的HCl的物质的量是参加反应的盐酸的物质的量的$\frac{5}{8}$,得到0.5mol氯气,消耗盐酸是1.6mol,被氧化的盐酸是1.6mol×$\frac{5}{8}$=1mol,故答案为:1.6mol;1mol.
点评 本题考查氧化还原反应的计算,把握发生的反应中物质的量的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列说法不正确的是( )
| A. | 建造三峡大坝使用了大量水泥,水泥属于硅酸盐材料 | |
| B. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 |
4.下列关于氯水的说法正确的是( )
| A. | 新制氯水中只含氯气和水分子 | |
| B. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| C. | 光照氯水有气泡逸出,该气体是氯气 | |
| D. | 氯水放置数天后pH将变大 |
13.用石墨电极电解CuCl2溶液(见如图).下列分析正确的是( )
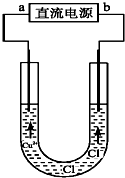

| A. | a端是直流电源的负极 | |
| B. | 阴极附近Cu2+浓度增大 | |
| C. | 阳极有铜析出 | |
| D. | 通电一段时间后,在阴极附近观察到黄绿色气体 |
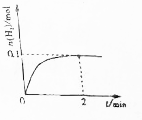 一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol
一定温度下,向2L密闭容器中加入1molNH3(g).发生反应2NH3(g)?3H2(g)+N2(g)△H=+92kJ/mol