题目内容
铝是人类生活中继铜、铁之后又一个重要的金属.工业上冶炼金属铝的原料来源于自然界中重要的矿物质钒土(主要成分:Al2O3;还有SiO2、Fe2O3、FeCO3、MgCO3等杂质).从钒土中提取得到Al2O3的工艺流程如图所示:

请回答下列问题:
(1)固体A所含物质的化学式(或分子式)是 .
(2)写出溶液A与气体B反应的离子方程式 .
(3)工业冶炼金属铝通常用石墨碳块作电解槽的阳极,请你根据电解原理解释电解冶炼铝的过程中,需要定期补充阳极碳块的原因 .
(4)Al2O3的熔点很高,因而在工业冶炼时,需将Al2O3的熔于熔化的冰晶石(Na3AlF6)中进行电解.有一位同学查阅资料发现,AlCl3的熔点很低.他提出:可通过电解熔融状态的AlCl3制取金属铝.你认为他提出的方案是否可行?为什么? .
(5)某企业用上述工艺流程进行生产,每10.0t钒土可得到金属铝1.35t.如果不考虑生产过程的损耗,请你计算每生产钒土中Al2O3的质量分数 .

请回答下列问题:
(1)固体A所含物质的化学式(或分子式)是
(2)写出溶液A与气体B反应的离子方程式
(3)工业冶炼金属铝通常用石墨碳块作电解槽的阳极,请你根据电解原理解释电解冶炼铝的过程中,需要定期补充阳极碳块的原因
(4)Al2O3的熔点很高,因而在工业冶炼时,需将Al2O3的熔于熔化的冰晶石(Na3AlF6)中进行电解.有一位同学查阅资料发现,AlCl3的熔点很低.他提出:可通过电解熔融状态的AlCl3制取金属铝.你认为他提出的方案是否可行?为什么?
(5)某企业用上述工艺流程进行生产,每10.0t钒土可得到金属铝1.35t.如果不考虑生产过程的损耗,请你计算每生产钒土中Al2O3的质量分数
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)矾土与稀盐酸反应生成金属阳离子后再和氢氧化钠反应生成的沉淀就是固体A;
(2)溶液A的溶质就是矾土与稀盐酸反应生成金属阳离子后再和氢氧化钠反应生成的可溶性物质含有AlO2-;
(3)电解时阳极失电子生成氧气,氧气在高温时会氧化碳块,使碳块消耗;
(4)AlCl3是共价化合物,在熔融状态下不导电,不能用来电解;
(5)根据Al元素质量守恒,1molAl生成0.5molAl2O3计算.
(2)溶液A的溶质就是矾土与稀盐酸反应生成金属阳离子后再和氢氧化钠反应生成的可溶性物质含有AlO2-;
(3)电解时阳极失电子生成氧气,氧气在高温时会氧化碳块,使碳块消耗;
(4)AlCl3是共价化合物,在熔融状态下不导电,不能用来电解;
(5)根据Al元素质量守恒,1molAl生成0.5molAl2O3计算.
解答:
解:(1)钒土主要成分是Al2O3,还有SiO2、Fe2O3、FeCO3、MgCO3等杂质,除SiO2不反应外,与盐酸反应生成的金属阳离子有Al3+、Fe3+、Fe2+、Mg2+等,这些金属阳离子再与氢氧化钠反应后生成的可溶物为NaAlO2,不溶物为Fe(OH)2、Fe(OH)3、Mg(OH)2;
故答案为:Fe(OH)2、Fe(OH)3、Mg(OH)2;
(2)由(1)知溶液A主要为NaAlO2溶液和剩余的氢氧化钠溶液,通入二氧化碳气体首先和氢氧化钠反应CO2+OH-═HCO3-,还有和NaAlO2的反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+OH-═HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)电解时阳极失电子生成氧气,氧气在高温条件下会氧化碳块,使碳块消耗,所以需要定期补充阳极碳块;
故答案为:电解冶炼铝的阳极产物为O2,在高温条件下,O2与阳极碳发生反应消耗阳极碳块;
(4)AlCl3是共价化合物,在熔融状态下不导电,不能用来电解,而氧化铝为离子化合物,在熔融状态下可导电,可以用来电解;
故答案为:不可行;AlCl3是共价化合物,熔融状态的AlCl3不导电;
(5)根据元素守恒,矾土中每1molAl会生成0.5molAl2O3,则以Al2O3表示的质量分数=
×100%=25.5%,故答案为:25.5%.
故答案为:Fe(OH)2、Fe(OH)3、Mg(OH)2;
(2)由(1)知溶液A主要为NaAlO2溶液和剩余的氢氧化钠溶液,通入二氧化碳气体首先和氢氧化钠反应CO2+OH-═HCO3-,还有和NaAlO2的反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:CO2+OH-═HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)电解时阳极失电子生成氧气,氧气在高温条件下会氧化碳块,使碳块消耗,所以需要定期补充阳极碳块;
故答案为:电解冶炼铝的阳极产物为O2,在高温条件下,O2与阳极碳发生反应消耗阳极碳块;
(4)AlCl3是共价化合物,在熔融状态下不导电,不能用来电解,而氧化铝为离子化合物,在熔融状态下可导电,可以用来电解;
故答案为:不可行;AlCl3是共价化合物,熔融状态的AlCl3不导电;
(5)根据元素守恒,矾土中每1molAl会生成0.5molAl2O3,则以Al2O3表示的质量分数=
| ||
| 10t×106g/t |
点评:本题为生产工艺流程题,涉及电解、计算等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难大.

练习册系列答案
相关题目
(B做)有一空瓶的质量为20g,问该瓶中充入氧气后的质量为36g,在相同的条件下充入某气体,其质量为34g,则该气体的摩尔质量为( )
| A、44g/mol |
| B、28g/mol |
| C、64g/mol |
| D、32g/mol |
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是( )
| A、MgO、Al2O3、SO2、CO2 |
| B、CO2、Cl2、CaO、SO3 |
| C、Cl2、Al2O3、N2O3、SO3 |
| D、SiO2、N2O5、CO、Cl2 |
有一含有Fe2O3和FeO的混合物样品,用5mol/L的盐酸48mL恰好完全溶解,所得溶液吸收0.672L(标准状况)氯气,其中的Fe2+恰好全部转化为Fe3+,该样品中Fe2O3和FeO的物质的量之比是( )
| A、1:1 | B、1:2 |
| C、1:3 | D、1:4 |
靛青是一种染料,利用元素分析仪分析其样品,发现它只含碳、氢、氧、氮四种元素,四种元素的质量分数分别如下:碳为73.3%、氢为3.8%、氮为10.7%、氧为12.2%.则靛青的最简式为( )
| A、C8H5NO |
| B、C2H2NO |
| C、C4H6NO |
| D、C7H8NO |



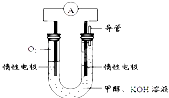 “低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.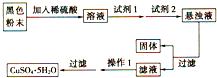 若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是
若经过实验分析确定,该黑色物质为氧化铜和氧化亚铁的混合物,实验小组欲利用该黑色粉末制取较纯净的硫酸铜,设计如图实验方案,则回答:试剂1是