题目内容
(B做)有一空瓶的质量为20g,问该瓶中充入氧气后的质量为36g,在相同的条件下充入某气体,其质量为34g,则该气体的摩尔质量为( )
| A、44g/mol |
| B、28g/mol |
| C、64g/mol |
| D、32g/mol |
考点:摩尔质量
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据氧气的质量计算氧气的物质的量,相同条件下体积之比等于物质的量之比,所以该气体的物质的量等于氧气的物质的量,根据M=
计算该气体的摩尔质量.
| m |
| n |
解答:
解:有一空瓶的质量为20 g,向该瓶充入氧气后的质量为36g,
则氧气质量为(36-20)g=16g,氧气的物质的量为
=0.5mol,
相同条件下体积之比等于物质的量之比,所以该气体的物质的量为0.5mol,mol,
相同条件下充入该气体,其质量为34g,则该气体质量为(34-20)g=14g.
所以该气体的摩尔质量为=
=28g/mol.
故选:B.
则氧气质量为(36-20)g=16g,氧气的物质的量为
| 16g |
| 32g/mol |
相同条件下体积之比等于物质的量之比,所以该气体的物质的量为0.5mol,mol,
相同条件下充入该气体,其质量为34g,则该气体质量为(34-20)g=14g.
所以该气体的摩尔质量为=
| 14g |
| 0.5mol |
故选:B.
点评:本题考查摩尔质量的计算,难度不大,根据体积相同推断出物质的量相同是解题关键.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2?6H2O晶体后,仍能大量共存的是( )
| A、Na+、H+、Cl-、NO3- |
| B、Na+、Mg2+、Cl-、SO42- |
| C、K+、Ba2+、OH-、I- |
| D、Cu2+、CO32-、Br-、ClO- |
下列有关化学用语表示不正确的是( )
A、氧的原子结构示意图: |
B、Na2O2的电子式: |
| C、HClO的结构式:H-O-Cl |
| D、中子数为16的硫离子:S2- |
NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A、O2和O3共32 g混合物中氧原子的个数为2NA |
| B、78 g苯含有C═C 键的数目为3NA |
| C、1 mol Na2O2固体中含离子总数为4NA |
| D、足量Fe与1 mol 氯气反应时转移的电子数为3NA |
下列对物质及其变化的有关叙述正确的是( )
| A、干冰气化时碳氧键发生断裂 |
| B、CaO和SiO2晶体中都不存在单个小分子 |
| C、K2O和K2O2中化学键类型完全相同 |
| D、苯分子中只有极性键 |
下列说法错误的是( )
| A、“血液透析”利用了胶体的性质 |
| B、向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| D、依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
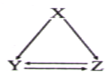 下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | AlCl3 | Al(OH)3 | NaAlO2 |
| B | C | CO | CO2 |
| C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
| D | S | SO2 | SO3 |
| A、A | B、B | C、C | D、D |
某气态烃0.5mol最多能与1mol HCl发生加成反应,所得产物又能与4molCl2发生取代反应,最后得到一种只含碳氯两种元素的化合物,则原气态烃为( )
| A、丙炔 | B、1-丁炔 |
| C、2-丁烯 | D、1-戊烯 |
